Professional Documents
Culture Documents
P3 27LevenspielChido
P3 27LevenspielChido
Uploaded by
Eduardo LeijaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
P3 27LevenspielChido
P3 27LevenspielChido
Uploaded by
Eduardo LeijaCopyright:
Available Formats
Ren Ros Cant
Jacobo Trevio Martnez
Jess Antonio Nio Mares
Eduardo Alejandro Arteaga Leija
Azael Nez Ortiz
Jonathan Francisco Rocha Rodrguez
La sustancia gaseosa pura A se prepara bajo
refrigeracin y se introduce en un capilar de
pared delgada que acta como recipiente de
reaccin, como se muestra en la figura.
Durante el manejo no hay reaccin
apreciable. El recipiente de reaccin se
introduce rpidamente en un bao de agua
hirviendo y el reactante A se descompone
completamente de acuerdo con la reaccin A
R + S, obtenindose los datos indicados.
1000 mm
Mercurio
Recipiente de Reaccin
A R + S
Agua Hirviendo
Tabla 1. Datos Experimentales.
Tiempo
(min)
0.5 1 1.5 2 3 4 6 10
Longitud
(cm)
6.1 6.8 7.2 7.5 7.85 8.1 8.4 8.7 9.4
Smbolo
i
N
io
Cambio N
i
C
i
=N
i
/V
var
P
i
=C
i
RT P
i
=Fn(P
io
)
A -1 N
Ao
-N
Ao
X N
Ao
(1-X) N
Ao
(1-X)/V
o
(1+X) N
Ao
(1-X)RT/V
o
(1+X) P
Ao
(1-X)/(1+X)
R 1 N
Ro
N
Ao
X N
Ao
(
R
+X) N
Ao
(
R
+X)/V
o
(1+X) N
Ao
(
R
+X)RT/V
o
(1+X) P
Ao
(
R
+X)/(1+X)
S 1 N
So
N
Ao
X N
Ao
(
S
+X) N
Ao
(
S
+X)/V
o
(1+X) N
Ao
(
S
+X)RT/V
o
(1+X) P
Ao
(
S
+X)/(1+X)
A R + S
1. Calculo del Coeficiente de Expansin.
o c
Ao
y =
1
1
1 2
1
=
=
=
o
Ao
y
1 = c
Tabla 2. Tabla Estequiomtrica.
2. Calculo de la Concentracin Inicial.
RT
P
C
nRT PV
Ao
Ao
=
=
Variable Valor Unidades
Presion 1.31578947 atm
Temperatura 373.15 K
Cte. Gases 0.08206 atm L / mol K
C
Ao
0.0429706 mol / L
0 0429 . 0 = = t cuando C
L
mol
Ao
3. Calculo del Volumen Inicial (Longitud Inicial).
Suponiendo:
A un tiempo muy grande (), la especie A se descompone completamente (Y
Ao
= 1).
Descomposicin de la especie A fase gas (Volumen variable) .
( )
( )
( ) X
L
L
X L L
X V V
f
o
o f
o f
c
c
c
+
=
+ =
+ =
1
1
1
Variable Valor Unidades
L
f
9.4 cm
1
X 1
L
o
4.7 cm
0 7 . 4 = = t cuando cm L
o
Tabla 3. Datos para calcular concentracin.
Tabla 4. Datos para calcular Longitud inicial.
Orden Reaccin Ecuacin Diferencial Ecuacin Integrada
Orden Cero
Primer Orden
Segundo Orden
( )
k
dt
LnV d C
r
Ao
A
= =
c
( )
A
Ao
A
kC
dt
LnV d C
r = =
c
( )
2
A
Ao
A
kC
dt
LnV d C
r = =
c
kt
V
V
Ln
C
o
Ao
=
c
kt
V
V
Ln
o
=
|
|
.
|
\
|
A
c
1
( )
kt C
V
V
Ln
V V
V
Ao
o o
=
|
|
.
|
\
|
A
+
A
A +
c
c
c
c
1
1
Tabla 5. Ecuaciones Cinticas.
Tiempo
(min)
0.5 1 1.5 2 3 4 6 10
Orden de Reaccin
0 0.01120356 0.01587163 0.01832776 0.0200819 0.02204181 0.02338897 0.02495171 0.0264596
y = 0.0013x + 0.0156
R = 0.717
0
0.005
0.01
0.015
0.02
0.025
0.03
0.035
0 5 10 15
(
C
a
o
/
)
*
L
n
(
V
/
V
o
)
Tiempo (min)
Orden Cero
Tabla 6. Datos para la Ecuacin de orden cero.
kt
V
V
Ln
C
o
Ao
=
c
Tiempo
(min)
0.5 1 1.5 2 3 4 6 10
Orden de Reaccin
1 0.35364004 0.59205106 0.75910515 0.90570862 1.10930758 1.28519824 1.54756251 1.90423745
y = 0.1548x + 0.5151
R = 0.9208
0
0.5
1
1.5
2
2.5
0 5 10 15
-
L
n
(
1
-
(
V
/
V
)
)
Tiempo (min)
Primer Orden
Tabla 7. Datos para Ecuacin Cintica de primer orden.
kt
V
V
Ln
o
=
|
|
.
|
\
|
A
c
1
Tiempo
(min)
0.5 1 1.5 2 3 4 6 10
Orden de Reaccin
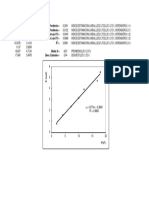
2 11.5158916 23.8147356 35.2245958 47.5129426 68.7727967 91.8202376 136.196308 221.647668
y = 22.084x + 2.2692
R = 0.9997
0
50
100
150
200
250
0 2 4 6 8 10 12
(
(
1
+
V
)
/
(
V
o
V
)
)
+
L
n
(
1
-
(
V
/
V
o
)
)
/
C
a
o
Tiempo (min)
Segundo Orden
Tabla 8. Datos para la Ecuacin de Segundo Orden.
( )
kt C
V
V
Ln
V V
V
Ao
o o
=
|
|
.
|
\
|
A
+
A
A +
c
c
c
c
1
1
Los datos experimentales para la reaccin A
R + S, obedecen a la cintica de 2do orden.
( )
kt C
V
V
Ln
V V
V
Ao
o o
=
|
|
.
|
\
|
A
+
A
A +
c
c
c
c
1
1
k=
22.084 L/mol min
Segundo Orden
k 22.084
R
2
0.9997
2
min
084 . 22
A mol
L
A
C r =
You might also like
- Enunciados CineticasDocument8 pagesEnunciados Cineticasgemmavecino18No ratings yet
- Problema PFRDocument8 pagesProblema PFRricardoNo ratings yet
- Reporte de Práctica "Cinética Química"Document8 pagesReporte de Práctica "Cinética Química"Itzebel Montserrat González VargasNo ratings yet
- Solucionario EXAME PARTE A OP ADocument4 pagesSolucionario EXAME PARTE A OP AJesús Fidalgo FernándezNo ratings yet
- Grafica 3Document1 pageGrafica 3Izan PradesNo ratings yet
- Memoria 1Document7 pagesMemoria 1martaNo ratings yet
- RLCSerie Memoria LaboratorioDocument13 pagesRLCSerie Memoria LaboratoriomartaNo ratings yet
- Identidades Trigonométricas IDocument1 pageIdentidades Trigonométricas IBranco ChallapaNo ratings yet
- 2022-Galicia-Enunciados e Solucións Da 1 Proba - Opción BDocument3 pages2022-Galicia-Enunciados e Solucións Da 1 Proba - Opción BLorena CastroNo ratings yet
- Solucionario EXAME PARTE A OP BDocument4 pagesSolucionario EXAME PARTE A OP BJesús Fidalgo FernándezNo ratings yet
- SOLUCION DE EJERCICIOS Diseno de ReactoresDocument6 pagesSOLUCION DE EJERCICIOS Diseno de ReactoresYamix QuispeNo ratings yet
- Identidades Variable Triple - MitadDocument2 pagesIdentidades Variable Triple - MitadCirculo Es Nivel50% (2)
- Segundo Deber 2016BDocument2 pagesSegundo Deber 2016BElizabeth JLNo ratings yet
- EXAMEN PARCIAL 01 - SoluciónDocument15 pagesEXAMEN PARCIAL 01 - Soluciónjairisaacdiazlozano83No ratings yet
- Matematicas IIIDocument185 pagesMatematicas IIIMacbookaluNo ratings yet
- Exercicios Equilibrio Qímico PAAU Galicia ResoltosDocument67 pagesExercicios Equilibrio Qímico PAAU Galicia ResoltosLiNo ratings yet
- TRIGO - Identidades TrigonométricasDocument1 pageTRIGO - Identidades TrigonométricascirculodeestudiohdNo ratings yet
- Tema1 AElectricidade - MagnitudesFundamentais.ResistoresDocument40 pagesTema1 AElectricidade - MagnitudesFundamentais.ResistoresfoxgreenNo ratings yet
- Tema 2.1 ElectroDocument11 pagesTema 2.1 ElectroClara EfeNo ratings yet
- L1 Indice de RefraccionDocument5 pagesL1 Indice de RefraccionFran VegaNo ratings yet
- Equilibrio QuimicoDocument58 pagesEquilibrio QuimicohumanNo ratings yet
- SOL GM Matematicas Maio2019 AzulDocument8 pagesSOL GM Matematicas Maio2019 AzulLuís ÁlvarezNo ratings yet
- Grafica 3Document1 pageGrafica 3Izan PradesNo ratings yet
- INFORME DE PRÁCTICAS (Quimica)Document5 pagesINFORME DE PRÁCTICAS (Quimica)Noemí Lorenzo GarcíaNo ratings yet
- Identidades TrigonométricasDocument9 pagesIdentidades TrigonométricasCarlos David Laura Quispe100% (1)
- CeS Exercicios 18-19 05Document2 pagesCeS Exercicios 18-19 05sararodriguezgomez99No ratings yet
- Neumatica 01 Principios Fisicos Da NeumaticaDocument21 pagesNeumatica 01 Principios Fisicos Da NeumaticaSergio Martínez LópezNo ratings yet
- TermoquimicaDocument34 pagesTermoquimicahumanNo ratings yet
- Solución Extraordinaria Matemáticas 2014Document8 pagesSolución Extraordinaria Matemáticas 2014Alejandro Iglesias GilNo ratings yet
- 2022-Galicia-Enunciados e Solucións Da 1 Proba - Opción ADocument4 pages2022-Galicia-Enunciados e Solucións Da 1 Proba - Opción ALorena CastroNo ratings yet
- 1-Ex. AutoavDocument4 pages1-Ex. Autoavashtm40205No ratings yet
- Tema 1.2 - PrácticasDocument15 pagesTema 1.2 - PrácticasRamón SánchezNo ratings yet
- Solucionario Tema 0. Termoquímica PDFDocument16 pagesSolucionario Tema 0. Termoquímica PDFMaria CasalNo ratings yet
- Solucionario EXAME PARTE A OP ADocument4 pagesSolucionario EXAME PARTE A OP AJesús Fidalgo FernándezNo ratings yet
- EEII Tema 1 Exercicios Resolucià NsDocument12 pagesEEII Tema 1 Exercicios Resolucià Nsmanubasannntee 1616No ratings yet
- Práctica 1. 0 OsciloscopioDocument9 pagesPráctica 1. 0 OsciloscopioAlvaro LamasNo ratings yet
- Divisor TensionDocument12 pagesDivisor TensionJ.P. 21No ratings yet
- Física Do Século XXDocument48 pagesFísica Do Século XXMr ADCNo ratings yet
- Solucionario Tema 3Document21 pagesSolucionario Tema 3Maria CasalNo ratings yet
- B6 Fisica XXABAUGalDocument30 pagesB6 Fisica XXABAUGalNatalia Sanchiño AnteloNo ratings yet
- P1 F4 2023 2 VF GABADocument18 pagesP1 F4 2023 2 VF GABAjgato906No ratings yet
- Integrales Por El Método de SimpsonsDocument18 pagesIntegrales Por El Método de SimpsonsCarlos Arca LizaNo ratings yet
- Soal Uas MSMDocument14 pagesSoal Uas MSMogijayapranaNo ratings yet
- Hidroneu ValsiDocument8 pagesHidroneu ValsiLfe FloNo ratings yet
- ACTIVIDAD MODULAR II CIENCIAS EXPERIMENTALES NombreDocument9 pagesACTIVIDAD MODULAR II CIENCIAS EXPERIMENTALES NombreArturo douglas garcia pincayNo ratings yet
- Ejemplo 3-7.2-1Document6 pagesEjemplo 3-7.2-1Nasir CanalesNo ratings yet
- Seminario 3Document3 pagesSeminario 3estudiosmundial23No ratings yet
- Caso Práctico 02. Ecuación de Rachford-RiceDocument2 pagesCaso Práctico 02. Ecuación de Rachford-Ricegemmavecino18No ratings yet
- Tarea 6 Vibraciones Modelado de Un ResorteDocument3 pagesTarea 6 Vibraciones Modelado de Un ResorteCristobal DavidNo ratings yet
- Ejerc-Deflex - MecDocument4 pagesEjerc-Deflex - MecKevin Huallpa EnriquezNo ratings yet
- CalorimetriaDocument66 pagesCalorimetriaCHRISTIAM ANTONY FLORES ZAMBRANONo ratings yet
- 2oBachCC EBAU Galicia 2020-Ordinaria Resuelto CiuGDocument8 pages2oBachCC EBAU Galicia 2020-Ordinaria Resuelto CiuGCarla Castillo FernándezNo ratings yet
- Gia Numero 4 de ConstruciónDocument5 pagesGia Numero 4 de ConstruciónRamón A. Barreto T.No ratings yet
- Vibracion ExitadaDocument3 pagesVibracion ExitadaMiguel Angel CastillaNo ratings yet