Professional Documents
Culture Documents
6 - Prvi Zakon Termodinamike
6 - Prvi Zakon Termodinamike
Uploaded by
mferi92Copyright:
Available Formats
You might also like
- Tekst ZadatakaDocument14 pagesTekst Zadatakamferi92No ratings yet
- Tekst ZadatakaDocument272 pagesTekst Zadatakamferi92No ratings yet
- 12 Treci ZakonDocument4 pages12 Treci Zakonmferi92No ratings yet
- 22 Predavanje-AminokiselineDocument10 pages22 Predavanje-Aminokiselinemferi92No ratings yet
- 8 - Drugi ZakonDocument15 pages8 - Drugi Zakonmferi92No ratings yet
- 11 Max RadDocument13 pages11 Max Radmferi92No ratings yet
- 9 - Konverzija Energije - TD SkalaDocument21 pages9 - Konverzija Energije - TD Skalamferi92No ratings yet
- 3 - Nulti ZakonDocument11 pages3 - Nulti Zakonmferi92No ratings yet
- 2 - Osnovni PojmoviDocument8 pages2 - Osnovni Pojmovimferi92No ratings yet
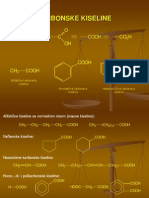
- 18.Predavanje-Karbonske KiselineDocument18 pages18.Predavanje-Karbonske Kiselinemferi92100% (1)
- 21.Predavanje-Supstituisane KiselineDocument17 pages21.Predavanje-Supstituisane Kiselinemferi92No ratings yet
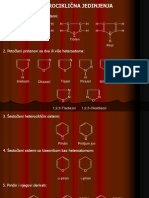
- 23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni RadikaliDocument25 pages23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni Radikalimferi92No ratings yet
- 19.Predavanje-Karbonske Kiseline-Nezasicene I DikarbonskeDocument14 pages19.Predavanje-Karbonske Kiseline-Nezasicene I Dikarbonskemferi92No ratings yet
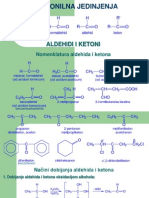
- 17.predavanje - Karbonilna JedinjenjaDocument18 pages17.predavanje - Karbonilna Jedinjenjamferi92No ratings yet
- 23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni RadikaliDocument25 pages23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni Radikalimferi92No ratings yet
6 - Prvi Zakon Termodinamike
6 - Prvi Zakon Termodinamike
Uploaded by
mferi92Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
6 - Prvi Zakon Termodinamike
6 - Prvi Zakon Termodinamike
Uploaded by
mferi92Copyright:
Available Formats
PRVI ZAKON TERMODINAMIKE
Bilans energije
The First Law of TD (conservation of energy)
Deutsches Museum, Mnchen
Robert Mayer discovered the first law of TD in 1842
Historical Formulation: Heat is a form of energy. Energy (the capacity for work) can only be converted into various external forms, and it cannot be created from nothing or destroyed (Robert Mayer,1842; James Prescott Joule, 1843; Hermann Helmholtz, 1847). A "perpetuum mobile," i.e. a machine capable of continuously producing work out of nothing, is impossible.
Original apparatus for determining the mechanical equivalent of heat, invented by Robert Mayer, 1868
PRVI ZAKON U KONANOM OBLIKU
Prvi zakon je bilans energije. On kae da se toplota dovedena sistemu raspodeljuje na poveanje njegove ukupne energije i rad koji se iz tog sistema moe dobiti:
Q E tot W
Etot U Ep Ek
tipian primer od znaaja za TD je sistem koji prima toplotu, a daje rad Q i W mehanizmi razmene energije sustema i njegove okoline
primeri jednostavnih termodinamikih sistema:
QA EA W A
QB WB EB
WC EC QC
PRVI ZAKON TD: za kompleksan termodinamiki sistem
Etot
Qo W1 Q3 Q4 Etot W2 W5 Q6
PRVI ZAKON U INFINITEZIMALNOM OBLIKU
Kada se prvi zakon napie kao diferencijalna jednaina, uoavaju se posebne oznake diferencijala za toplotu i rad zato to toplota i rad nisu funkcije stanja nego procesa.
Q dE W
Posledica ijenice da toplota i rad nisu funkcije stanja nego procesa je da njihov diferencijal ne moe da se integrali kao pravi diferencijal:
Q Q2 Q1
1
W W2 W1
1
Ova tvrdnja e biti dokazana, ali na suprotan nain. Naime, bie pokazano da se diferencijali dQ i dW mogu reiti samo kada se poistovete sa energijom E koja je funkcija stanja.
1. Specijalni termodinamiki sistem (izjednaavanje rada sa energijom)
WA
Sistem A:
0 dEA WA WA dEA
WA EA1 EA2
W W2 W1
1 2
2. Specijalni termodinamiki sistem (izjednaavanje toplote sa energijom)
Sistem B:
Q B dE B
Q B
1 2
dE B E B 2 E B 1
1
QB
Q Q2 Q1
1
Q i W su naini kako je dolo do promena energije sistema
nisu funkcije stanja ve su funkcije procesa!
V=konst. dW=0 dQ=dU T=konst. dU=0 dQ=dW Q=0 (adijabatski proces) dW=dU
RAD
You might also like
- Tekst ZadatakaDocument14 pagesTekst Zadatakamferi92No ratings yet
- Tekst ZadatakaDocument272 pagesTekst Zadatakamferi92No ratings yet
- 12 Treci ZakonDocument4 pages12 Treci Zakonmferi92No ratings yet
- 22 Predavanje-AminokiselineDocument10 pages22 Predavanje-Aminokiselinemferi92No ratings yet
- 8 - Drugi ZakonDocument15 pages8 - Drugi Zakonmferi92No ratings yet
- 11 Max RadDocument13 pages11 Max Radmferi92No ratings yet
- 9 - Konverzija Energije - TD SkalaDocument21 pages9 - Konverzija Energije - TD Skalamferi92No ratings yet
- 3 - Nulti ZakonDocument11 pages3 - Nulti Zakonmferi92No ratings yet
- 2 - Osnovni PojmoviDocument8 pages2 - Osnovni Pojmovimferi92No ratings yet
- 18.Predavanje-Karbonske KiselineDocument18 pages18.Predavanje-Karbonske Kiselinemferi92100% (1)
- 21.Predavanje-Supstituisane KiselineDocument17 pages21.Predavanje-Supstituisane Kiselinemferi92No ratings yet
- 23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni RadikaliDocument25 pages23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni Radikalimferi92No ratings yet
- 19.Predavanje-Karbonske Kiseline-Nezasicene I DikarbonskeDocument14 pages19.Predavanje-Karbonske Kiseline-Nezasicene I Dikarbonskemferi92No ratings yet
- 17.predavanje - Karbonilna JedinjenjaDocument18 pages17.predavanje - Karbonilna Jedinjenjamferi92No ratings yet
- 23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni RadikaliDocument25 pages23.Predavanje-Heterocikli, Metaloorganska Jed. I Slobodni Radikalimferi92No ratings yet