Professional Documents
Culture Documents
Ruijter (2010) Laboratoriumonderzoek Van Erfelijke Metabole Ziekten Lysosomale Stapelingsziekten
Ruijter (2010) Laboratoriumonderzoek Van Erfelijke Metabole Ziekten Lysosomale Stapelingsziekten
Uploaded by
BoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ruijter (2010) Laboratoriumonderzoek Van Erfelijke Metabole Ziekten Lysosomale Stapelingsziekten
Ruijter (2010) Laboratoriumonderzoek Van Erfelijke Metabole Ziekten Lysosomale Stapelingsziekten
Uploaded by
BoCopyright:
Available Formats
Literatuur
1 Ruijter GJG, Diggelen OP van, Verheijen FW,
Schoonderwoerd GC, Bruggenwirth HT, Mancini
GMS, Halley DJJ, Huijmans JGM. Laboratorium-
onderzoek van erfelijke metabole ziekten: lysoso-
male stapelingsziekten. Tijdschr Kindergeneeskd.
2010;78:49-56.
2 Aldenhoven M, Hasselt PM van, Boelens JJ.
Stamceltransplantatie voor aangeboren stofwis-
selingsziekten. Tijdschr Kindergeneeskd. 2010;
78:88-96.
3 Ru MH de, Wijburg FA, Aerts JMFG, Post EDM,
Hollak CEM. Anemie, trombocytopenie en hepa-
tosplenomegalie: de ziekte van Gaucher. Tijdschr
Kindergeneeskd. 2010;78:73-77.
4 Valstar MJ, Dahhan T, Poorthuis BP, Snoeck I,
Wijburg FA. Langdurige neonatale icterus met la-
ter ataxie, verticale blikparese en progressieve
mentale achteruitgang: de ziekte van Niemann-
Pick type C. Tijdschr Kindergeneeskd. 2010;
78:77-80.
Laboratoriumonderzoek van erfelijke metabole
ziekten: lysosomale stapelingsziekten
G.J.G. Ruijter, O.P. van Diggelen, F.W. Verheijen, G.C. Schoonderwoerd, H.T. Bruggenwirth,
G.M.S. Mancini, D.J.J. Halley, J.G.M. Huijmans
Inleiding
De laboratoriumdiagnostiek van erfelijke meta-
bole ziekten (EMZ) is in Nederland onderdeel
van de klinisch-genetische diagnostiek en wordt
voor een belangrijk deel uitgevoerd in de acht
universitaire medische centra. De diagnostische
laboratoria zijn in het kader van kwaliteitsbor-
ging vrijwel allemaal geaccrediteerd. Diagnos-
tiek van deze aandoeningen is complex en wordt
steeds vaker een samenspel tussen metaboliet-,
enzym- en DNA-diagnostiek. Over het algemeen
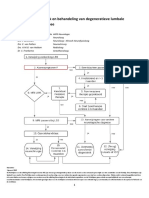
verloopt diagnostiek naar EMZ getrapt (figuur
1). De gebruikelijke opeenvolgende niveaus zijn:
1 klinische selectie;
2 orienterend klinisch-chemisch onderzoek;
3 screenend metabool onderzoek (basisdiag-
nostiek);
4 enzymdiagnostiek;
5 DNA-diagnostiek.
Op basis van klinische symptomen en eventueel
orienterend klinisch-chemisch onderzoek zal
een kinderarts, (kinder)neuroloog, internist of
klinisch geneticus beslissen of een erfelijke me-
tabole ziekte tot de mogelijkheden behoort.
Hierbij is het belangrijk te realiseren dat EMZ
afzonderlijk weliswaar zeldzaam zijn, maar col-
lectief zeker niet. De geboorteprevalentie van ly-
sosomale stapelingsziekten als groep wordt in
Nederland nu geschat op 1:3500. In 1999 is dit
berekend op 1:7000,
1
maar er worden steeds
vaker voorheen niet-herkende milde vormen
van lysosomale stapelingsziekten gevonden.
Het is daarom aan te bevelen EMZ parallel aan
andere oorzaken van de ziekte bij de patient te
onderzoeken. Dit is in het bijzonder van belang
voor de prognose van een kind met een behan-
Samenvatting
Het klinisch beeld van erfelijke metabole ziekten (EMZ) is zeer
variabel, van bijzonder mild tot niet-verenigbaar met het leven.
Deze klinische heterogeniteit in combinatie met de zeldzaamheid
van individuele EMZ kan het stellen van een diagnose bemoeilij-
ken. Recente ontwikkelingen in zowel de diagnostiek als de be-
handeling van EMZ hebben de prognose voor patienten met EMZ
aanzienlijk verbeterd en maken het essentieel dat er voldoende
kennis van deze aandoeningen is bij (kinder)artsen. Om tot een
snelle en nauwkeurige diagnose van EMZ te komen, is gespeci-
aliseerde diagnostiek vereist naar (1) metabolietconcentraties in
bloed en urine, (2) enzymactiviteit(en) in bloedcellen, gekweekte
huidfibroblasten of weefselbiopten, en (3) genmutaties. Dit arti-
kel beschrijft een aantal kanten van deze drie niveaus van labo-
ratoriumdiagnostiek van EMZ, waaronder mogelijkheden en be-
perkingen, maar ook praktische aspecten zoals in te zenden
monsters. Vanwege de complexiteit van genetische metabole
aandoeningen willen wij in dit artikel onderstrepen dat overleg
tussen aanvrager en laboratorium enerzijds en laboratoria on-
derling anderzijds van groot belang is. Dit geldt in het bijzonder
voor de lysosomale stapelingsziekten, waarvoor gericht inzetten
van diagnostiek een voorwaarde is om tot de juiste diagnose te
komen.
Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2 49
delbare EMZ. Ook bij een onbegrepen ontwikke-
lingsachterstand zal naast bijvoorbeeld chromo-
soomdiagnostiek volgens de NVK-richtlijnen,
(zie www.nvk.pedianet.nl), onderzoek naar
EMZ ingezet worden.
Per 1 januari 2007 is de neonatale screening uit-
gebreid van e en (PKU) naar zeventien aandoe-
ningen, veertien hiervan zijn EMZ (met name
defecten in vetzuuroxidatie en aminozuurmeta-
bolisme). Hier verloopt het diagnostisch proces
geheel anders, aangezien pasgeborenen met een
van de gescreende ziekten in de regel gediagno-
sticeerd worden voordat er klinische verschijn-
selen zijn. Na een positief resultaat in de hiel-
prikscreening wordt gerichte metaboliet- of en-
zymdiagnostiek uitgevoerd om een definitieve
diagnose te kunnen stellen. Neonatale scree-
ning naar lysosomale stapelingsziekten wordt
in Nederland nog niet toegepast, maar momen-
teel wordt een haalbaarheidsstudie uitgevoerd
naar screening voor de ziekte van Pompe, MPS
I, II en VI.
In dit artikel zullen de verschillende stappen in
de laboratoriumdiagnostiek van erfelijke meta-
bole aandoeningen worden behandeld. De mo-
gelijkheden en beperkingen van de verschil-
lende vormen van diagnostiek zullen hierbij be-
licht worden. De besproken themas zullen in
zekere mate toegespitst zijn op lysosomale sta-
pelingsziekten.
Erfelijke metabole ziekten: een korte schets
EMZ kenmerken zich door een genetisch bepaald
defect in een stap van het metabolisme. Dit kan
het metabolisme van eenvoudige verbindingen
betreffen, zoals aminozuren, suikers, vetzuren,
purinen en pyrimidinen, maar ook van complexe
moleculen, zoals mucopolysachariden en glycoli-
piden. Meestal is het defecte genproduct een en-
zym of transporteiwit, maar het kan ook een ac-
tivatoreiwit, een hormoon of een receptor zijn.
Defecten kunnen in katabole routes voorkomen
(bijv. aminozuurafbraak, verzuuroxidatie), of in
biosynthetische routes (bijv. glycosylering van ei-
witten). Als gevolg van het defect functioneert
een metabole route niet of nauwelijks. Dit leidt
tot ophoping van het substraat van de defecte en-
zymreactie en/of een tekort van een essentiele
stof achter het metabole blok in de route. De
sterk verhoogde concentratie van het substraat
kan de vorming van andere afwijkende (toxische)
metabolieten veroorzaken. Ten slotte kan een ei-
witdefect tot gevolg hebben dat een compleet or-
ganel niet functioneert, zoals bij mucolipidose II
(I-cell disease), waarbij lysosomale enzymen door
foutieve posttranslationele modificatie niet naar
Figuur 1: Flow van de laboratoriumdiagnostiek bij de belangrijkste categorieen van erfelijke stofwisselingsziekten.
a
Per diagnostiekgroep is het benodigde materiaal aangegeven: U: urine; P: heparineplasma; CSF: liquor; B: heparinebloed;
BE: EDTA-bloed; F: fibroblasten; S: spier; L: lever.
50 Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2
het lysosoom gaan, maar door de cel uitgeschei-
den worden.
De symptomatologie van EMZ is zeer gevari-
eerd. Het is niet mogelijk daar in dit artikel uit-
voerig op in te gaan. In de literatuur is echter
een aantal uitstekende overzichtsartikelen en
handboeken beschikbaar om tot een goede dif-
ferentiaaldiagnose te komen.
2-6
Op basis van
klinische en diagnostische kenmerken is het
mogelijk een praktische indeling te maken in
drie groepen:
ziekten die intoxicatie geven;
ziekten in de energiestofwisseling;
aandoeningen met defecten in de biosynthese
of afbraak van complexe moleculen.
2
De intoxicatiegroep omvat defecten in de af-
braak van aminozuren (bijv. tyrosinemie),
ureumcyclusdefecten, organoacidurieen (bijv.
methylmalonacidurie) en defecten in suikeraf-
braak (bijv. galactosemie). Routine klinisch-che-
misch onderzoek is voor deze ziekten richting-
gevend voor zowel de initiele behandeling als
het vervolgonderzoek. Klinisch zijn de ziekten
in deze groep vergelijkbaar door een symptoom-
vrije periode gevolgd door een intoxicatie met
verschijnselen als lethargie, braken, voedselwei-
gering, convulsies, coma en gestoorde lever-
functie. Dit kan acuut optreden, maar kan ook
een langzaam progressief beloop hebben met
uiteindelijk groei- en ontwikkelingsachterstand.
Veel van deze aandoeningen zijn behandelbaar
en de behandeling richt zich doorgaans op het
voorkomen van ophoping van toxische verbin-
dingen door middel van een dieet.
7
De tweede groep betreft stoornissen in de ener-
gieproductie, zoals defecten in het creatineme-
tabolisme, het pyruvaatmetabolisme, de citroen-
zuurcyclus, de mitochondriale ademhalingske-
ten en de vetzuuroxidatie (bijv. medium chain
acyl-CoA dehydrogenase deficiency, MCADD).
Tot deze groep worden ook afwijkingen in de
glucosehomeostase zoals glycogeenstapelings-
ziekten (behalve de ziekte van Pompe, GSD II)
en gluconeogenese defecten gerekend. Klinisch
wordt deze groep getypeerd door o.a. het voor-
komen van lactaatacidemie en/of hypoglykemie,
groeiachterstand, spierzwakte, cardiomyopathie
en sudden infant death syndrome. Routine kli-
nisch-chemisch onderzoek is ook voor deze
groep van aandoeningen buitengewoon belang-
rijk om therapie en vervolgdiagnostiek in te
kunnen zetten. Aandoeningen die gepaard gaan
met hypoglykemie zijn in zekere mate behandel-
Tabel 1: Klinische symptomen die kunnen voorkomen bij lysosomale stapelingsziekten. Per subgroep van lysosomale stape-
lingsziekten is aangegeven of de genoemde symptomen hierbij kunnen voorkomen
a
M
u
c
o
p
o
l
y
s
a
c
h
a
r
i
d
o
s
e
n
O
l
i
g
o
s
a
c
h
a
r
i
d
o
s
e
n
e
n
s
i
a
a
l
z
u
u
r
s
t
a
p
e
l
i
n
g
s
z
i
e
k
t
e
S
f
i
n
g
o
l
i
p
i
d
o
s
e
n
M
u
c
o
l
i
p
i
d
o
s
e
n
I
,
I
I
,
I
I
I
N
e
u
r
o
n
a
l
e
c
e
r
o
d
-
l
i
p
o
f
u
s
c
i
n
o
s
e
n
(
N
C
L
)
L
i
p
i
d
e
s
t
a
p
e
l
i
n
g
s
z
i
e
k
t
e
n
(
N
i
e
m
a
n
n
-
P
i
c
k
C
,
W
o
l
m
a
n
)
Z
i
e
k
t
e
v
a
n
P
o
m
p
e
knik in de ontwikkeling + + + + + + +
mentale retardatie, progressieve dementie + + + + + +
spasticiteit, afwijkende tonus + + + + +
oogafwijkingen (corneatroebeling, cherry red
spot, blikparese, blindheid)
+ + + + + +
hepatosplenomegalie + + + (+) +
skeletafwijkingen + + + +
grof gelaat + + (+) +
hydrops foetalis + + + +
convulsies + + + + +
MRI-afwijkingen + + + + +
huid- of haarafwijkingen + + +
cardiomyopathie + (+) + +
spierzwakte +
a
Niet alle symptomen hoeven voor te komen. Symptomen kunnen ook zeer beperkt zijn. Alle ziektebeelden presenteren zich
als een spectrum van zeer mild tot zeer ernstig (zie ook andere bijdragen in deze uitgave).
Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2 51
baar, dit in tegenstelling tot bijvoorbeeld mito-
chondriale defecten.
7
De derde groep (complexe moleculen) wordt
gevormd door o.a. lysosomale stapelingsziekten
(bijv. ziekte van Gaucher, ziekte van Pompe en de
mucopolysacharidosen), peroxisomale aandoe-
ningen (bijv. syndroom van Zellweger), defecten
van de cholesterolbiosynthese (bijv. syndroom
van Smith-Lemli-Opitz) en congenitale defecten
in de glycosylering (CDG-syndroom). Aandoe-
ningen in deze groep worden veelal gekarakteri-
seerd door psychomotore retardatie, dysmorfie-
en, knik in de ontwikkeling en gehoor- of visus-
afwijkingen. Klinische verschijnselen die kunnen
voorkomen bij lysosomale stapelingsziekten zijn
samengevat in tabel 1. Het belang van routine kli-
nische chemie is voor deze groep beperkt. Wel
kan een bloeduitstrijkje van nut zijn als scree-
nende techniek vanwege het voorkomen van ge-
vacuoliseerde leukocyten bij lysosomale stape-
lingsziekten. Behandeling is voor de meeste van
deze aandoeningen niet mogelijk, maar daar
komt langzaam verandering in zoals bijvoorbeeld
met enzymvervangingstherapie of stamceltrans-
plantatie bij lysosomale stapelingsziekten (zie
andere bijdragen in dit themanummer).
Metabole basisdiagnostiek: screenend
onderzoek naar EMZ
Metabole basisdiagnostiek is een screenende
vorm van diagnostiek met als doel het opsporen
van afwijkende metabolietpatronen in lichaams-
vloeistoffen door toepassing van geavanceerde
analysetechnieken (elektroforese, HPLC, gas-
chromatografie-massaspectrometrie en tan-
dem-massaspectrometrie. Deze multicompo-
nentanalyses worden toegepast voor bepaling
van o.a. aminozuren, organische zuren, suikers,
acylcarnitinen, galzuren, purinen en pyrimidi-
nen. Voor diagnostiek naar mucopolysacharido-
sen wordt door middel van een spectrofotome-
trische bepaling de excretie van mucopolysacha-
riden (ook wel glycosaminoglycanen, GAG)
gemeten. Indien deze uitscheiding verhoogd
is, kan met een een- of tweedimensionale elek-
troforesetechniek onderzocht worden welke
GAG het betreft (dermatansulfaat, heparansul-
faat, keratansulfaat of chondro tinesulfaat).
Omdat het GAG-patroon voor een aantal muco-
polysacharidosen identiek is, is enzymdiagnos-
tiek noodzakelijk om het precieze defect vast te
kunnen stellen (zie hieronder).
Vanwege het specialistische karakter van meta-
bole diagnostiek en de diversiteit van erfelijke
metabole ziekten beslist meestal een metabool
gespecialiseerde (bio)chemicus (klinisch chemi-
cus EMZ of klinisch biochemisch geneticus)
welke analyses uitgevoerd dienen te worden bij
een patient. Om een zo compleet mogelijk on-
derzoek in te kunnen zetten, is het van belang
dat de juiste monsters ingestuurd worden sa-
men met uitgebreide klinische informatie van
Tabel 2: Monstertypen benodigd voor diagnostiek naar erfelijke metabole ziekten
Monstertype Hoeveelheid
a
Verzendconditie Opmerking
basisdiagnostiek urine
heparineplasma
liquor
20-30 ml
1-2 ml
0,5-1 ml
bevroren
bevroren
bevroren
bij acute klinische
verschijnselen:
crisismonsters
b
enzymdiagnostiek
prenatale
enzymdiagnostiek
heparinebloed
huidbiopt (fibroblasten)
overige weefselbiopten
chorionvlokken
vruchtwater
5-10 ml
20-50 mg
20 mg
20 ml
kamertemperatuur
kamertemperatuur, in
kweekmedium
bevroren, soms vers
in kweekmedium, steriel,
uitgezocht
kamertemperatuur, steriel
vooraf overleg
b
vooraf overleg
b
vooraf overleg
b
DNA-diagnostiek EDTA-bloed
(geen heparinebloed)
gekweekte cellen
(vnl. fibroblasten)
chorionvlokken
vruchtwatercellen
(ongekweekt/gekweekt)
2 10 ml kamertemperatuur
vooraf overleg
b
vooraf overleg
b
vooraf overleg
b
a
Bij uitzondering is een kleinere hoeveelheid mogelijk voldoende (bijv. bij neonaten).
b
Voor cytodiagnostiek (inclusief prenataal onderzoek) is vooraf overleg met het betreffende laboratorium en aankondiging
van het moment van inzenden noodzakelijk.
52 Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2
de patient. Voor metabole diagnostiek is vrijwel
altijd zowel urine als plasma nodig (tabel 2, zie
ook figuur 1). Slechts in een enkel specifiek ge-
val volstaat e en van deze twee monstertypen.
Soms is onderzoek in liquor ge ndiceerd. Bij
een acuut ziek kind is het essentieel dat mon-
sters voor metabool onderzoek in de crisisfase
afgenomen worden, zodat de kans om een even-
tuele afwijking vast te stellen zo groot mogelijk
is. Het verstrekken van klinische gegevens,
maar ook resultaten van routine klinisch-che-
misch onderzoek, eventuele medicatie en speci-
ale voeding, is cruciaal; het bepaalt welk onder-
zoek wordt uitgevoerd. Zo zal bij een kind met
een ontwikkelingsachterstand een heel ander
onderzoeksprogramma worden ingezet dan bij
een kind met nierstenen. De metabool gespeci-
aliseerde laboratoria hebben hiertoe speciale
aanvraagformulieren ontworpen (zie onder
meer www.gmzrotterdam.nl, www.metabole-
ziekten.nl, www.lmzg.nl en www.metaboleziek-
ten.nl/lab). Daarnaast is telefonisch overleg mo-
gelijk, bijvoorbeeld als spoeddiagnostiek ge-
wenst is.
Het metabole laboratorium interpreteert testuit-
slagen in het licht van de specifieke omstandig-
heden van de patient. In geval er een diagnose
gesteld wordt, adviseert de chemicus met be-
trekking tot eventueel vervolgonderzoek (figuur
1) en mogelijkheden voor behandeling. Bij een
afwijkend resultaat dat relevant is voor behande-
ling of diagnose wordt zo spoedig mogelijk (te-
lefonisch) contact gezocht met de aanvragende
specialist. Het is belangrijk dat aanvragers zich
realiseren dat niet alle EMZ uitgesloten zijn als
standaard screenend metabool onderzoek is uit-
gevoerd. Zo zijn sommige EMZ met de beschik-
bare tests in de metabole basisdiagnostiek niet
op te sporen. Een voorbeeld hiervan zijn de sfin-
golipidosen, een groep binnen de lysosomale
stapelingsziekten (o.a. ziekte van Gaucher,
ziekte van Krabbe). Voor deze ziekten wordt de
laboratoriumdiagnostiek gestart met enzymdi-
agnostiek (figuur 1). Daarom is het aan te raden
overleg te voeren met chemici uit het metabole
laboratorium of met een metabool gespeciali-
seerde arts als er, ondanks negatieve resultaten
in standaard metabool onderzoek, toch het ver-
moeden blijft bestaan dat er iets metabool niet
pluis is aan de patient.
Enzymdiagnostiek
Indien de metabole basisdiagnostiek wijst op
een genetische enzymdeficientie, is enzymon-
derzoek de aangewezen volgende stap in het di-
agnostische traject (figuur 1). Waar metabole
basisdiagnostiek informatie geeft over groepen
ziekten, is enzymonderzoek zeer fijnmazig:
een enzymtest geeft alleen informatie over een
bepaalde ziekte. Zelfs een klinische entiteit (bijv.
ziekte van Sanfilippo; mucopolysacharidose ty-
pe III) kan veroorzaakt worden door verschil-
lende enzymdeficienties (MPS III, type A, B, C
en D). Met metabole basisdiagnostiek zijn deze
subtypen niet te onderscheiden.
De complexiteit van de technieken voor enzymdi-
agnostiek en daarmee de doorlooptijden lo-
pen sterk uiteen. Zo worden de relatief eenvou-
dige lysosomale enzymbepalingen doorgaans
wekelijks uitgevoerd. Daarnaast zijn er zeer be-
werkelijke bepalingen, die noodzakelijkerwijs
veel langere doorlooptijden hebben (bijv. de gly-
cogenosen, mitochondriale defecten en DNA-re-
pair-defecten). Voor sommige EMZ kan een een-
duidige diagnose niet door enzymdiagnostiek ge-
steld worden en is aanvullende diagnostiek,
bijvoorbeeld DNA-analyse, nodig. Idealiter wordt
elke indexpatie nt in combinatie met de ouders zo-
wel enzymatisch als genetisch gekarakteriseerd.
Enzymdiagnostiek wordt bij voorkeur uitge-
voerd op bloedmonsters, omdat dit materiaal
eenvoudig is te verkrijgen, wat de doorlooptij-
den bekort (tabel 2). Dit geldt ook voor vrijwel
alle lysosomale stapelingsziekten. Sommige en-
zymen zijn echter weefselspecifiek en dat maakt
de invasieve ingreep van biopteren noodzakelijk
(spier of lever voor bijv. sommige glycogenosen
en mitochondriale defecten). Veelal volstaat een
naaldbiopt. Soms is het noodzakelijk het mate-
riaal vers (niet ingevroren) in te zenden. Voor
andere EMZ worden biochemische routes door-
gemeten in levende cellen. Meestal worden hier
gekweekte huidfibroblasten voor gebruikt. Door
het opkweken van het huidbiopt worden de
doorlooptijden met 5-6 weken celkweektijd ver-
lengd. Een veelbelovende ontwikkeling in de en-
zymdiagnostiek is het gebruik van gedroogde
bloedspots (Guthrie-kaarten). Hiervoor zijn
slechts minieme hoeveelheden bloed nodig die
via een vingerprik verkregen kunnen worden;
een groot voordeel voor de patient en voor het
verzenden van het materiaal. Voor een aantal ly-
sosomale stapelingsziekten is aangetoond dat
de enzymdiagnostiek betrouwbaar is (bijv.
ziekte van Fabry, ziekte van Hurler).
8,9
Met de
bestaande conventionele enzymbepalingen zal
niet alle enzymdiagnostiek voor lysosomale sta-
pelingsziekten mogelijk worden op gedroogde
Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2 53
bloedspots. Momenteel wordt enzymdiagnos-
tiek op gedroogde bloedspots nauwelijks toege-
past in Nederland. Vanwege het belang van een
vroegtijdige start van behandeling wordt in en-
kele landen reeds neonatale screening uitge-
voerd voor o.a. de ziekte van Pompe door mid-
del van enzymdiagnostiek in gedroogde bloed-
spots, maar er is zeker nog aanvullend
onderzoek noodzakelijk alvorens dit voor de
ziekte van Pompe of een van de andere lysoso-
male stapelingsziekten betrouwbaar en veilig in
Nederland kan worden ge ntroduceerd.
Enzymdiagnostiek is ook prenataal mogelijk.
Aangezien veel EMZ zeer ernstige aandoeningen
zijn en behandeling vaak niet goed mogelijk is,
geeft prenatale enzymdiagnostiek ouders de op-
tie om een zwangerschap van een aangedane foe-
tus te beeindigen. Ten eerste vereist dit een zorg-
vuldige genetische counseling van de ouders in
een van de klinisch genetische centra. Een voor-
waarde voor prenatale enzymdiagnostiek is dat
de exacte laboratoriumdiagnose bij de indexpa-
tient vastgesteld is en dat beide ouders enzyma-
tisch onderzocht zijn. De enzymactiviteit bij de
ouders moet goed te onderscheiden zijn van de
enzymdeficientie bij de indexpatient. Dit laatste
is essentieel vanwege het mogelijke voorkomen
van zogenoemde pseudodeficienties van het en-
zym in laboratoriumbepalingen. Hierbij wordt in
het laboratorium een sterk verlaagde enzymacti-
viteit gemeten, terwijl dit in vivo niet het geval is
en dus geen klinische consequenties heeft. In
dergelijke situaties is DNA-diagnostiek noodza-
kelijk (zie onder). Meer dan honderd genetisch
metabole ziekten kunnen met een prenatale test
al vroeg in de zwangerschap worden vastgesteld
in chorionvlokken, vruchtwater of gekweekte
vruchtwatercellen (zie www.gmzrotterdam.nl).
Meestal kan dit met behulp van een enzymatische
test, soms door het bepalen van de ophopende
metabolieten. Vooraf overleg met het laboratori-
um is noodzakelijk om het meest geschikte uit-
gangsmateriaal te bepalen. Chorionvlokken wor-
den rond de 11e week van de zwangerschap afge-
nomen, en de uitslag is gewoonlijk binnen enkele
dagen bekend. Soms zijn gekweekte villuscellen
nodig en duurt de uitslag ongeveer twee weken.
Vruchtwater wordt pas rond de 16e week afgeno-
men en meestal is nog twee tot drie weken tijd
nodig om hier voldoende cellen uit op te kweken
voor de enzymbepaling. Voor veel defecten is ook
directe prenatale DNA-analyse mogelijk, onder
de voorwaarde dat het enzymdefect met de bijbe-
horende mutatie(s) in de familie al tijdig, voor de
volgende zwangerschap, zijn vastgesteld (zie ver-
der hierna). In de praktijk betekent dit dat de
ouders vroegtijdig, c.q. na het stellen van de diag-
nose bij de indexpatient, worden verwezen naar
een klinisch geneticus voor genetic counseling.
DNA-diagnostiek
Een toenemend aantal genen betrokken bij EMZ
is bekend. Vooral bij lysosomale stapelingsziek-
ten is genotypering van de indexpatient inmid-
dels usance. De gouden standaard voor het stel-
len van de diagnose is een aangetoonde enzym-
deficientie. Daarom zal in de regel DNA-
diagnostiek de laatste stap in het diagnostisch
proces zijn (figuur 1). Het aantonen van homo-
zygotie, compound heterozygotie of hemizygo-
tie voor duidelijk pathogene mutaties in het be-
trokken gen vormt dan de ultieme bevestiging
van de diagnose in deze groep (autosomaal re-
cessieve of X-linked) aandoeningen. Hierbij is
het aantonen van mutaties bij beide ouders
een onlosmakelijk onderdeel, zoals hieronder
zal worden toegelicht. Indien het resultaat van
de enzymdiagnostiek niet eenduidig is, wat zich
kan voordoen bij een atypische presentatie of
een juveniele/adulte vorm van de ziekte, kan
het resultaat van het DNA-onderzoek zelfs door-
slaggevend zijn. Dit geldt ook voor de vrouwe-
lijke dragers van de X-gebonden aandoeningen
ziekte van Fabry en ziekte van Hunter, die zich
met symptomen kunnen presenteren. Enzymdi-
agnostiek zal waarden laten zien in de heterozy-
gote of normale range. DNA-diagnostiek is hier
altijd noodzakelijk om de ziekte aan te tonen
(zie ook later in deze paragraaf ).
Een speciale situatie ontstaat wanneer op voor-
hand bekend is dat bepaalde klinisch neutrale
genvarianten (in de literatuur vaak polymorfis-
men genoemd) kunnen leiden tot een pseudo-
deficientie van het enzym in laboratoriumbepa-
lingen. Bekende voorbeelden zijn het GAA-gen
(ziekte van Pompe), het GLA-gen (ziekte van Fa-
bry) en het ARSA-gen (metachromatische leu-
kodystrofie).
10
Ook in die gevallen speelt DNA-
analyse een directe diagnostische rol, omdat de
DNA-uitslag nodig is om het enzymonderzoek
goed te kunnen interpreteren.
Van wie is materiaal voor DNA-analyse nodig? Ui-
teraard is het gewenste startpunt het testen van
de indexpatient. Indien de patient overleden is en
er geen materiaal beschikbaar is, is in het geval
van een autosomaal recessieve aandoening als
voorbeeld, het testen van beide ouders, die im-
mers obligate dragers zijn, een goed alternatief.
54 Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2
Tegenwoordig beschouwen we ook de DNA-
diagnostiek van de patient zelf pas als afgerond
als beide ouders getest zijn. Hiervoor bestaat een
aantal redenen, die deels een technische, deels
een biologische achtergrond hebben. De meeste
pathogene mutaties in deze genen zijn subtiele
(kleine) mutaties, die met behulp van directe se-
quentiebepaling van de coderende exonen en
omringende intronsequenties worden onder-
zocht. Dat betekent dat de PCR-techniek centraal
staat in de tests. Vinden we een klaarblijkelijk ho-
mozygoot patroon, dan berust dat in verreweg de
meeste gevallen ook op homozygotie: beide
ouders dragen dezelfde (founder)mutatie bij.
Soms echter zien we slechts een allel en is het
andere allel op dat punt in het gen gedeleteerd.
Ook is mogelijk dat een wel degelijk aanwezig
allel geen PCR-product kan genereren, omdat
zich in de aanhechtingsplaats van de voor de
PCR-reactie benodigde primers een zeldzaam
polymorfisme bevindt. Als e en van beide primers
niet kan hechten, komt de PCR-reactie niet op
gang en lijkt het alsof uitsluitend het andere allel
met de bekende mutatie aanwezig is: pseudoho-
mozygotie. Naarmate de ervaring met DNA-diag-
nostiek van deze aandoeningen toeneemt, doen
zich vaker genetisch ongebruikelijke bevindingen
voor, zoals twee genvarianten op een en hetzelfde
allel. Testen van de ouders levert de informatie op
of beide ouderlijke allelen gedefinieerd zijn of dat
het DNA-onderzoek, met aangepaste of alterna-
tieve technieken, moet worden voortgezet. In-
middels is in ons laboratorium voor een groeiend
aantal genen een kwantitatieve techniek opera-
tioneel, waarmee grovere mutaties zoals deleties
en duplicaties van e en of meer exonen opge-
spoord kunnen worden.
Wat is het doel van DNA-analyse? Afgezien van
een rol in de primaire diagnostiek van de index-
patient, zoals hierboven genoemd, kan DNA-
analyse tot doel hebben verdere diagnostiek in
de familie te ondersteunen of mogelijk te ma-
ken. Om te beginnen kan het nuttig zijn het ge-
notype achter de hand te hebben bij prenatale
diagnostiek. In de meeste gevallen wordt prena-
tale enzymdiagnostiek toegepast, tegenwoordig
vaak aangevuld door een (DNA-)test op mater-
nale contaminatie van het onderzochte foetale
materiaal. De kracht van prenatale enzymdiag-
nostiek is de snelheid. Blijkt echter bij vooron-
derzoek (bijvoorbeeld) dat een van de ouders
een relatief lage enzymactiviteit heeft, dan kan
een interpretatieprobleem bij prenataal onder-
zoek voorzien worden. DNA-diagnostiek is
dan een goed alternatief. Vooraf overleg met
het laboratorium is noodzakelijk om de meest
geschikte benadering vast te stellen.
Dragerschaponderzoek bij familieleden kan al-
leen met DNA-diagnostiek betrouwbaar uitge-
voerd worden. Enzymdiagnostiek volstaat hier
nooit. Of dragerschaponderzoek aan naaste fa-
milieleden met een kinderwens moet worden
aangeboden, is een punt van discussie. Tegen-
standers wijzen op het lage a-priori drager-
schaprisico van de partner van een drager van
een familiaire mutatie, ervan uitgaande dat de
partner niet tot de familie behoort. Inderdaad
zijn de populatierisicos op dragerschap van
EMZ laag, voor bijvoorbeeld lysosomale stape-
lingsziekten veelal minder dan 1:100.
1
Toch
zou men de risicos kunnen onderschatten, om-
dat bekend is dat bepaalde mutaties regionaal in
relatief hoge frequentie voorkomen. Door dit
foundereffect kan een schijnbaar niet-verwante
partner uit dezelfde regio toch een verhoogd ri-
sico op het dragen van een mutatie hebben. Ons
standpunt is dat als ook aan de partner een test
kan worden aangeboden, dragerschaponder-
zoek wel degelijk waardevol kan zijn. Als vol-
doende informatie bestaat over de frequentie
waarmee de verschillende mutaties in de bevol-
king voorkomen, kunnen partners getest wor-
den op een pakket bekende mutaties. Het test-
resultaat verlaagt in verreweg de meeste geval-
len het risico op een aangedaan kind aanzien-
lijk. In een enkel geval zal ook de partner als
drager worden ge dentificeerd. Prenatale diag-
nostiek is dan mogelijk zonder dat eerst een
kind met de aandoening geboren is. Gezien de
complexiteit van EMZ vindt dragerschaponder-
zoek (bij gezonde personen) bij voorkeur alleen
plaats in het kader van genetic counseling in een
van de klinisch-genetische centra.
Ten slotte: De technische mogelijkheden nemen
toe. Voor aanvragers geldt het advies om voor
een update van de mogelijkheden (of als er vra-
gen zijn) rechtstreeks contact op te nemen met
de laboratoriumspecialist; in het geval van DNA-
diagnostiek is dat de klinisch-moleculair gene-
ticus. Informatie over DNA-diagnostiek (waar
uitgevoerd en welk materiaal in te sturen) is
voor Nederland te vinden op www.dnadiagnos-
tiek.nl.
Na de diagnose
Een kind met een erfelijke metabole ziekte zal in
de regel begeleid worden door een metabool ge-
specialiseerd (kinder)arts in een van de UMCs.
Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2 55
Indien mogelijk zal therapie worden ingezet.
Soms is dat relatief eenvoudig; bij bijvoorbeeld
MCAD-deficientie dient vasten te worden voor-
komen. Bij andere aandoeningen wordt een di-
eet ingesteld met beperking van een of meer
componenten die zelf toxisch zijn of toxische
intermediairen kunnen vormen (bijv. een fenyla-
laninebeperkt dieet bij PKU). Daarnaast kan
suppletie van essentiele verbindingen of vitami-
nen nodig zijn, zoals bij PKU het aminozuur ty-
rosine waarvan de vorming uit fenylalanine de-
fect is. Therapiemonitoring wordt uitgevoerd
door het metabole laboratorium.
Nieuwere vormen van therapie bij o.a lysosoma-
le stapelingsziekten, zoals enzymvervangings-
therapie, stamceltransplantatie of substraatre-
ductietherapie, worden uitvoerig beschreven in
andere bijdragen in dit themanummer.
Ten slotte: Vanwege de complexe genetische
problematiek en de consequenties voor familie-
leden, zoals herhalingsrisico en de mogelijkheid
dat gezonde familieleden dragers zijn of zelfs
ziek kunnen worden, is betrokkenheid van een
klinisch geneticus van groot belang.
Dankbetuiging
De auteurs danken prof. dr. A.T. van der Ploeg
en prof. dr. F.A. Wijburg voor het kritisch lezen
van het manuscript.
Auteurs
Dhr. dr. G.J.G. Ruijter, dhr. dr. O.P. van Diggelen, dhr.
dr. F.W. Verheijen, dhr. dr. G.C. Schoonderwoerd, mw. dr.
H.T. Bru ggenwirth, mw. dr. G.M.S. Mancini, mw. dr.
D.J.J. Halley, dhr. dr. J.G.M. Huijmans, afdeling
Klinische Genetica, Erasmus MC, Rotterdam.
Correspondentieadres: Dr. G.J.G. Ruijter, afdeling
Klinische Genetica Ee2471, Centrum voor Lyso-
somale en Metabole Ziekten, Erasmus MC,
Postbus 2040, 3000 CA Rotterdam, g.ruijter@
erasmusmc.nl.
Literatuur
1 Poorthuis BJ, Wevers RA, Kleijer WJ, et al. The
frequency of lysosomal storage diseases in The
Netherlands. Hum Genet. 1999;105:151-6.
2 Saudubray JM, Nassogne MC, de Lonlay P, Touati
G. Clinical approach to inherited metabolic dis-
orders in neonates: an overview. Semin Neonatol.
2002;7:3-15.
3 Burton BK. Inborn errors of metabolism in infancy:
a guide to diagnosis. Pediatrics. 1998; 102:e69.
4 Fernandes J, Saudubray J-M, Berghe G van den,
Walter JH, eds. Inborn metabolic diseases, 4th ed.
Berlin: Springer, 2006.
5 Blau N, Duran M, Blaskovics ME, Gibson KM, eds.
Physicians guide to the laboratory diagnosis of
metabolic diseases, 2nd ed. Berlin: Springer, 2003.
6 Scriver CR, Beaudet Al, Sly WS, Valle D, eds. The
metabolic & molecular bases of inherited disease,
8th ed. New York: McGraw-Hill, 2001.
7 Saudubray JM, Sedel F, Walter JH. Clinical ap-
proach to treatable inborn metabolic diseases: an
introduction. J Inherit Metab Dis. 2006;29:261-74.
8 Chamoles NA, Blanco MB, Gaggioli D, Casentini
C. Hurler-like phenotype: enzymatic diagnosis in
dried blood spots on filter paper. Clin Chem. 2001;
47:2098-102.
9 Ruijter GJG, El Bouyakoubi N, Vries R de, Poort-
huis BJHM. Enzymdiagnostiek van lysosomale
stapelingsziekten in gedroogde bloedspots. Ned
Tijdschr Klin Chem Labgeneesk. 2005;30:249-54.
10 Poorthuis BJHM, Brouwer OF, Groener JEM. Me-
tachromatische leukodystrofie: diagnostische val-
kuilen, klinische variabiliteit en mogelijkheden
voor therapie. Ned Tijdschr Klin Chem Labge-
neesk. 2003;28:356-9.
Summary
Inborn errors of metabolism (IEM) display very diverse clinical
symptoms, ranging from very mild to incompatible with life. The
clinical heterogeneity may complicate diagnosis of these rare
diseases. Recent advances in diagnosis as well as treatment of
IEM have improved the prognosis for patients with IEM consi-
derably and necessitate an update of knowledge on these disor-
ders among pediatricians. To facilitate prompt and accurate
diagnosis of IEM, expert analyses of (1) metabolites in blood and
urine, (2) enzyme levels in blood cells, cultured fibroblasts or
tissues, and (3) genetic defects are required. This paper illustrates
several aspects of these three categories of laboratory diagnostics
and emphasizes the need to share information, not only between
doctor and laboratory, but also between the different laboratories.
56 Ti j ds c hr Ki nder genees kd 2010 - 78 - nr 2
You might also like
- Labwaarden InterpreterenDocument16 pagesLabwaarden InterpreterenNilka DambukaNo ratings yet
- 1e Bach VUBDocument12 pages1e Bach VUBazerty2009-2010No ratings yet
- Samenvatting - Medische KennisDocument26 pagesSamenvatting - Medische KennisSuzanneIJzermanNo ratings yet
- Interne Week.2 ZO 5 LeukemieDocument5 pagesInterne Week.2 ZO 5 LeukemieMilton ChinNo ratings yet
- Samenvatting Interne Geneeskunde in DutchDocument191 pagesSamenvatting Interne Geneeskunde in DutchArooj KharlNo ratings yet
- Celijakija 2013Document12 pagesCelijakija 2013DanijelaMarkulinNo ratings yet
- Leervragen Toets 1,1 Jaar 3Document129 pagesLeervragen Toets 1,1 Jaar 3Throwaway1337No ratings yet
- Week 1 Inleiding in de OncologieDocument25 pagesWeek 1 Inleiding in de OncologieWieke NijmeijerNo ratings yet
- Samenvatting - Inleiding Gerontologie en GeriatrieDocument8 pagesSamenvatting - Inleiding Gerontologie en GeriatrieRomeo MikeNo ratings yet
- College Zeldzame Endocriene Tumoren 26-6-2013Document19 pagesCollege Zeldzame Endocriene Tumoren 26-6-2013Kuan ChunNo ratings yet
- 45 Anemie Januari-2021Document56 pages45 Anemie Januari-2021thesisfibricheckNo ratings yet
- Q1 Diabetes: B1Mgz K2 A1Document32 pagesQ1 Diabetes: B1Mgz K2 A1Kenz YoussefNo ratings yet
- Advies GentherapieDocument94 pagesAdvies GentherapieKlaudiaNo ratings yet
- Noordegraaf, Ewoud Marinus PDFDocument132 pagesNoordegraaf, Ewoud Marinus PDFDei VidNo ratings yet
- Syllabus - Biologie 2020Document117 pagesSyllabus - Biologie 2020andarijessieNo ratings yet
- 103 Dementie April-2020Document115 pages103 Dementie April-2020lihuimao123456No ratings yet
- NHG-Standaard Diabetes Mellitus Type 2Document33 pagesNHG-Standaard Diabetes Mellitus Type 2Arry FirmansyahNo ratings yet
- Askep LeukemiaDocument15 pagesAskep Leukemiashinta maharaniNo ratings yet
- WegnerDocument100 pagesWegnerFabiola NogaNo ratings yet
- H31 SnoekHogenelst Diabetes 2020Document13 pagesH31 SnoekHogenelst Diabetes 2020d.toman.vuNo ratings yet
- Het Empty-Sella Syndroom Als Oorzaak Van PanhypopituitarismeDocument4 pagesHet Empty-Sella Syndroom Als Oorzaak Van PanhypopituitarismeAvelox FloxNo ratings yet
- Artikel Eveline Elenbaas PolyfarmacieDocument4 pagesArtikel Eveline Elenbaas Polyfarmacieapi-294202126No ratings yet
- FCS+MetS GhentUni2Document10 pagesFCS+MetS GhentUni2Soham MajumdarNo ratings yet
- Richtlijnen Riskant Bij Ouderen Met Meerdere Chronische AandoeningenDocument2 pagesRichtlijnen Riskant Bij Ouderen Met Meerdere Chronische AandoeningenYayasan Ikhlas Kota KinabaluNo ratings yet
- CasussenDocument16 pagesCasussenlokkeprinsNo ratings yet
- Casus 1Document14 pagesCasus 1Faysal BenaliNo ratings yet
- Interne Geneeskunce1Document20 pagesInterne Geneeskunce1dr.koohboriNo ratings yet
- Syllabus Blok 2.4 2017Document41 pagesSyllabus Blok 2.4 2017Maxim AnninkNo ratings yet
- Inleiding Geriatrische PatiëntDocument8 pagesInleiding Geriatrische Patiëntmara.charlotteNo ratings yet
- Osteoporose PraktijkrichtlijnDocument20 pagesOsteoporose Praktijkrichtlijntomvdb10No ratings yet
- p06-09 Liga03 2022Document4 pagesp06-09 Liga03 2022championwhyNo ratings yet
- Lumbale Spinale Kanaal Stenose 2021Document11 pagesLumbale Spinale Kanaal Stenose 2021Mathé DuistermaatNo ratings yet
- Huisartsenbrochure MarfansyndroomDocument12 pagesHuisartsenbrochure MarfansyndroomMaigieNo ratings yet
- Pathophysiologic Aspects of Feline Hepatic Lipidosis: Chiara ValtolinaDocument175 pagesPathophysiologic Aspects of Feline Hepatic Lipidosis: Chiara ValtolinaMr. questionNo ratings yet
- JANS-2200326_MM_Patientenmap_Complete_BENLDocument176 pagesJANS-2200326_MM_Patientenmap_Complete_BENLMaarten VliegerNo ratings yet
- Mendel Unplugged : Niet-Mendeliaanse Overerving Bij Monogenische AandoeningenDocument62 pagesMendel Unplugged : Niet-Mendeliaanse Overerving Bij Monogenische AandoeningenMarie GokounousNo ratings yet
- Gizi BurukDocument4 pagesGizi Burukmiftahul hasanahNo ratings yet
- Vergrote LymfeklierenDocument5 pagesVergrote LymfeklierenBernard van RossumNo ratings yet
- Radboud: 81 MGZK2-1 MGZ-Iijntoets (Semester 1, Q2)Document34 pagesRadboud: 81 MGZK2-1 MGZ-Iijntoets (Semester 1, Q2)Kenz YoussefNo ratings yet
- Bloedanalyse - Gebruik Makende Van Hematologische ParametersDocument18 pagesBloedanalyse - Gebruik Makende Van Hematologische ParametersYassir HalimiNo ratings yet
- Oncologie SamenvattingDocument27 pagesOncologie Samenvattingypedejong1929No ratings yet
- Examen Kindergeneeskunde Wikimedica 2018b56Document14 pagesExamen Kindergeneeskunde Wikimedica 2018b56aficien csgoNo ratings yet
- Floppy InfantDocument12 pagesFloppy InfantSiham HalusiNo ratings yet
- Afp Op8 Kwetsbare OuderenDocument17 pagesAfp Op8 Kwetsbare OuderenyoussraNo ratings yet
- Algemene Pathologie Bij de NeonatusDocument35 pagesAlgemene Pathologie Bij de NeonatusLaura GoekintNo ratings yet
- BewegingspathologieDocument85 pagesBewegingspathologieTamar FoppenNo ratings yet
- Coeliakie en TandheelkundeDocument6 pagesCoeliakie en TandheelkundeRayssapnNo ratings yet
- Auto-Immuunziekten Van Endocriene Organen PDFDocument7 pagesAuto-Immuunziekten Van Endocriene Organen PDFjetgdtNo ratings yet
- Antiepilepsia 2012Document14 pagesAntiepilepsia 2012Dra Carolina Escalante Neurologa de AdultosNo ratings yet
- Taak 11Document11 pagesTaak 11J BessemsNo ratings yet
- Deelopdracht2 - Senne Voermans - 1073962Document2 pagesDeelopdracht2 - Senne Voermans - 1073962Morteza Kazemi vanhariNo ratings yet
- Geriatrie - Cursus 2022-2023 ExamenvragenDocument26 pagesGeriatrie - Cursus 2022-2023 Examenvragenihsanpolat04.ipNo ratings yet
- Weetjes VGTDocument28 pagesWeetjes VGTChopina707No ratings yet
- From Cell To Molecule Lectures Theme 2Document16 pagesFrom Cell To Molecule Lectures Theme 2iremNo ratings yet
- Hoorcollege Klinische Voeding November 2010bbDocument65 pagesHoorcollege Klinische Voeding November 2010bbSjeem AboulhadiNo ratings yet
- Assign Met 1Document70 pagesAssign Met 1MastewalNo ratings yet
- Werkcollege Hoofdstuk 8 - 001Document7 pagesWerkcollege Hoofdstuk 8 - 001xiaoyoubergerNo ratings yet
- Week 3 - DiarreeDocument58 pagesWeek 3 - DiarreeDeja PrebevšekNo ratings yet
- NijhofDocument220 pagesNijhofMansoura CafeNo ratings yet