Professional Documents
Culture Documents
Bab 3 DIFL
Bab 3 DIFL
Uploaded by
Irham Hikmawan RamadhanCopyright:
Available Formats
You might also like
- Resistant StarchDocument17 pagesResistant StarchIrham Hikmawan RamadhanNo ratings yet
- NO. Elements Page NoDocument21 pagesNO. Elements Page NoandriasNo ratings yet
- V2 (m/s) V1 (m/s) P1 (Pa) P2 (Pa) Q (m^3/h) fasumido v (m/s) Re fcalculado L (m) D (m) z1 (m) z2 (m) ε (m) RR=ε/D μ (kg/ (m*s) ) g (m/s^2) ρ (kg/m3) γ (N/m3) ν (m2/s)Document4 pagesV2 (m/s) V1 (m/s) P1 (Pa) P2 (Pa) Q (m^3/h) fasumido v (m/s) Re fcalculado L (m) D (m) z1 (m) z2 (m) ε (m) RR=ε/D μ (kg/ (m*s) ) g (m/s^2) ρ (kg/m3) γ (N/m3) ν (m2/s)DiegoAlexNo ratings yet
- Course: Soil Mechanics II Code: CVNG 2009 Lab: Consolidation Name: Adrian Rampersad I.D:809001425Document16 pagesCourse: Soil Mechanics II Code: CVNG 2009 Lab: Consolidation Name: Adrian Rampersad I.D:809001425Adrian Mufc RampersadNo ratings yet
- Tabel Hidrograf Inflow: Baiq Gita Aulia F1A019030Document6 pagesTabel Hidrograf Inflow: Baiq Gita Aulia F1A019030SUHARTINo ratings yet
- Baiq Gita AuliaDocument6 pagesBaiq Gita AuliaSUHARTINo ratings yet
- Traxial Test Lab Full ReportDocument14 pagesTraxial Test Lab Full ReportMohd Nik Harith Fawwaz100% (3)
- Ml/s X 0.1 N 0.0538 N: 0 NaohDocument2 pagesMl/s X 0.1 N 0.0538 N: 0 NaohNabilaFatinKamilasariNo ratings yet
- Rain Water Basin DesignDocument11 pagesRain Water Basin DesignSturza AnastasiaNo ratings yet
- Gas Absorption Lab ReportDocument12 pagesGas Absorption Lab ReportGracylla RoseNo ratings yet
- Lab Report - Determination of The Stability Constant of A Metal ComplexDocument18 pagesLab Report - Determination of The Stability Constant of A Metal ComplexValerie MangasarNo ratings yet
- Experiment No. 1 (CRE II - RTD MFR (Pulse) )Document6 pagesExperiment No. 1 (CRE II - RTD MFR (Pulse) )Prashant GiriNo ratings yet
- Lab#1 Fall2018Document8 pagesLab#1 Fall2018Qasim SafdarNo ratings yet
- Kelompok 6 - Assignment - 4Document7 pagesKelompok 6 - Assignment - 4Messa Adi SaputraNo ratings yet
- Data NormalDocument44 pagesData NormalJuancho TusinNo ratings yet
- Lab 6Document6 pagesLab 6Khuresh ShahNo ratings yet
- DataDocument18 pagesDataMohaiminNo ratings yet
- Concentration Vs Conductivity: 1.0 Results, Discussion and Analysis 1.1 Calibration CurveDocument9 pagesConcentration Vs Conductivity: 1.0 Results, Discussion and Analysis 1.1 Calibration CurveAhZaiSkyNo ratings yet
- Tabel Perhitungan Gambar Keruntuhan Muka 1ADocument9 pagesTabel Perhitungan Gambar Keruntuhan Muka 1Afajar sulaimanNo ratings yet
- Exercise. Sedimentation or Tickening.Document11 pagesExercise. Sedimentation or Tickening.Valeria cNo ratings yet
- Lab QADocument4 pagesLab QALeonardo YamashiroNo ratings yet
- TNLCD LabDocument9 pagesTNLCD LabtworedpartyhatsNo ratings yet
- QuizzzDocument16 pagesQuizzzfaidahNo ratings yet
- Analysis of Large Diameter Cyclone Plant Performance. Proc. 9th Aust. Coal Prep. Conf., Yeppoon, Oct. 2002 (Aust. Coal Prep - Soc.), 68-89Document22 pagesAnalysis of Large Diameter Cyclone Plant Performance. Proc. 9th Aust. Coal Prep. Conf., Yeppoon, Oct. 2002 (Aust. Coal Prep - Soc.), 68-89JD FCNo ratings yet
- Case Study 1Document22 pagesCase Study 1JD FCNo ratings yet
- Bernoulli 08 LabDocument20 pagesBernoulli 08 LabsdjdsfNo ratings yet
- A. Tabel Data PengmatanDocument4 pagesA. Tabel Data PengmatanAdinda NurNo ratings yet
- Book 1Document6 pagesBook 1Yuki KurniawanNo ratings yet
- 408 Exp 1Document14 pages408 Exp 1goabaone kgopaNo ratings yet
- EXCERCISEDocument4 pagesEXCERCISEHussen MohammedNo ratings yet
- Physics Lab Report - PendulumDocument8 pagesPhysics Lab Report - PendulumRyan SongNo ratings yet
- Determination of Critical Micelle ConcentrationDocument8 pagesDetermination of Critical Micelle ConcentrationthikamenituyeniNo ratings yet
- Ukom LatDocument4 pagesUkom LatTanti KharismatikaNo ratings yet
- 8/15/94 A-1 Niosh Manual of Analytical MethodsDocument1 page8/15/94 A-1 Niosh Manual of Analytical MethodsLuis Felipe Mera GrandasNo ratings yet
- Heat Exchanger ExperimentDocument21 pagesHeat Exchanger ExperimentKai Zun WongNo ratings yet
- Perhitungan Difusivitas IntegralDocument12 pagesPerhitungan Difusivitas IntegralamosagungNo ratings yet
- Non Electrolyte Solutes From Surface Tension ChangeDocument6 pagesNon Electrolyte Solutes From Surface Tension ChangethikamenituyeniNo ratings yet
- Flow Meter Orifice CalculationDocument27 pagesFlow Meter Orifice CalculationLaksono BudiNo ratings yet
- Timber Piles by KDocument3 pagesTimber Piles by KKamran AliNo ratings yet
- A - 3-4 Component DensitiesDocument5 pagesA - 3-4 Component Densitiesayisha.maharramovaNo ratings yet
- X vs. T 2: 1) Tablas de Tiempo Al Cuadrado Tabla 1 0 0,22 0,43 0,62 0,825 M 0 0,8336 1,685 2,471 3,323329 S 2Document6 pagesX vs. T 2: 1) Tablas de Tiempo Al Cuadrado Tabla 1 0 0,22 0,43 0,62 0,825 M 0 0,8336 1,685 2,471 3,323329 S 2kustNo ratings yet
- Laporan MixingDocument32 pagesLaporan Mixingrizal yahdyNo ratings yet
- Seawater PDFDocument2 pagesSeawater PDFHartinie MNo ratings yet
- Esterification of EthanolDocument15 pagesEsterification of EthanolSadia HasanNo ratings yet
- Bab Iv Hasil Dan Pembahasan: Rata-Rata 1 1 2 2Document4 pagesBab Iv Hasil Dan Pembahasan: Rata-Rata 1 1 2 2desvianadfNo ratings yet
- Convecção Forçada - G6Document9 pagesConvecção Forçada - G6Julia CellaNo ratings yet
- Hydrological and Hydraulic Analysis Example (1) .Xls AgutanDocument13 pagesHydrological and Hydraulic Analysis Example (1) .Xls AgutanKevin CondeNo ratings yet
- Tabel Pengamatan Modul 4Document5 pagesTabel Pengamatan Modul 4andryNo ratings yet
- Pengolahan Data H10 - Kelompok 07Document6 pagesPengolahan Data H10 - Kelompok 07Iqbal RoroaNo ratings yet
- Table Hydrometer TestDocument3 pagesTable Hydrometer TestSue JinsueNo ratings yet
- Flood Frequency Analysis Estimation of Design H.F.L. of River Tipkai AT RCC Bridge Khoraghat Gauge SiteDocument10 pagesFlood Frequency Analysis Estimation of Design H.F.L. of River Tipkai AT RCC Bridge Khoraghat Gauge SiteNILRATAN SARKARNo ratings yet
- Andrew Hamonangan Nadapdap B Module01Document22 pagesAndrew Hamonangan Nadapdap B Module01012 Andrew Hamonangan NadapdapNo ratings yet
- Data Praktikum Isoterm AdsorpsiDocument7 pagesData Praktikum Isoterm Adsorpsirudi salamNo ratings yet
- Lesson 3: Measure Moment Solid Object Inertia by Oscillation MethodDocument3 pagesLesson 3: Measure Moment Solid Object Inertia by Oscillation MethodLe Tung QuanNo ratings yet
- Lampiran A Laporan Sementara Ekstraksi Padat CairDocument2 pagesLampiran A Laporan Sementara Ekstraksi Padat CairRicky Putra SiregarNo ratings yet
- Principalele Caracteristici Ale Navei Şi Modelului Experimental Tabelul 1. Caracteristicile Navei Şi Ale Modelului ExperimentalDocument6 pagesPrincipalele Caracteristici Ale Navei Şi Modelului Experimental Tabelul 1. Caracteristicile Navei Şi Ale Modelului ExperimentalGenoveva StraticaNo ratings yet
- Problem SolutionDocument4 pagesProblem SolutionKarar AL-DahlkiNo ratings yet
- Fluids Laboratory Experiment (Friction Loss Along A Pipe)Document17 pagesFluids Laboratory Experiment (Friction Loss Along A Pipe)Chrionny AlumediNo ratings yet
- Estimativa de Propriedades de Óleos Vegetáis e Acidos Graxos 21.03.15.0Document87 pagesEstimativa de Propriedades de Óleos Vegetáis e Acidos Graxos 21.03.15.0Eng AlfNo ratings yet
- Enhanced Oil Recovery: Resonance Macro- and Micro-Mechanics of Petroleum ReservoirsFrom EverandEnhanced Oil Recovery: Resonance Macro- and Micro-Mechanics of Petroleum ReservoirsRating: 5 out of 5 stars5/5 (1)
- Wheat FlourDocument8 pagesWheat FlourIrham Hikmawan RamadhanNo ratings yet
- Lembar 1 Dari 3 HalamanDocument3 pagesLembar 1 Dari 3 HalamanIrham Hikmawan RamadhanNo ratings yet
- 013101367X TocDocument6 pages013101367X TocIrham Hikmawan RamadhanNo ratings yet
- Coll OidsDocument77 pagesColl OidsIrham Hikmawan RamadhanNo ratings yet
Bab 3 DIFL
Bab 3 DIFL
Uploaded by
Irham Hikmawan RamadhanOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Bab 3 DIFL
Bab 3 DIFL
Uploaded by
Irham Hikmawan RamadhanCopyright:
Available Formats
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-1
BAB III
HASIL PERHITUNGAN DAN PEMBAHASAN
III.1.Hasil Perhitungan
Tabel III.1.1 Tabel Perhitungan Untuk Konsentrasi NaCl 0,5M Pertama
NaCl 0.5 M
(S/m) Ca(mol/lt) Ca (mol/m3) T (C)
t(min)
3 1.401 30
1.14862E-07 0.000114862
30
6 1.453
1.21107E-07 0.000121107
9 1.532 1.24585E-07 0.000124585 30
12 1.576 1.25771E-07 0.000125771 30
15 1.591 1.31383E-07 0.000131383 30
18 1.662 1.34625E-07 0.000134625 30
21 1.703 1.38656E-07 0.000138656 30.2
24 1.754 1.49249E-07 0.000149249 30.2
27 1.888 1.49802E-07 0.000149802 30.5
30 1.895 30.5
1.14862E-07 0.000114862
Tabel III.1.2 Tabel Perhitungan Untuk Konsentrasi NaCl 0,5 M Kedua
NaCl 0.5 M
(S/m) Ca(mol/lt) Ca (mol/m3) T (C)
t(min)
3 1.706 29
1.35573E-07 0.000135573
6 1.715 1.36126E-07 0.000136126 29
9 1.722 1.36285E-07 0.000136285 29
12 1.724 29
1.36759E-07 0.000136759
15 1.730 1.38182E-07 0.000138182 29.4
18 1.748 1.3913E-07 0.00013913 29.4
21 1.760 1.40158E-07 0.000140158 29.8
24 1.773 1.41423E-07 0.000141423 29.8
27 1.789 1.42767E-07 0.000142767 29.8
30 1.806 1.36759E-07 0.000136759 30
Laboratorium Teknik Kimia FTI-
ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-2
Tabel III.1.3 Tabel Perhitungan Untuk Konsentrasi NaCl 0.,5 M Ketiga
NaCl 0.5 M
(S/m) Ca(mol/lt) Ca (mol/m3) T (C)
t(min)
3 1.960 29.3
1.54941E-07 0.000154941
6 1.962 1.55099E-07 0.000155099 29.3
9 1.966 1.55415E-07 0.000155415 29.5
12 1.970 1.55731E-07 0.000155731 29.5
15 1.978 1.56364E-07 0.000156364 29.5
18 1.980 1.56522E-07 0.000156522 29.5
21 1.983 1.56759E-07 0.000156759 29.8
24 1.986 1.56996E-07 0.000156996 29.8
27 1.992 1.5747E-07 0.00015747 29.8
30 2.060 1.62846E-07 0.000162846 29.8
III.2 Pembahasan
Tujuan dari percobaan ini adalah untuk menentukan koefisien difusivitas dari
larutan NaCl dalam aquadest. Dalam percobaan ini, variabel yang digunakan adalah
konsentrasi larutan NaCl, yakni 0,5 M, dan yang dijaga pada suhu konstan, sesuai dengan
suhu rata rata air laut pada siang dan malam hari. Peralatan yang digunakan dalam
percobaan ini adalah conductometer, tangki difusi berukuran 17 x 17 x 8,5 cm, pipa difusi dari
PVC, sel difusi setebal 1 cm, magnetic stirrer, dan thermometer. Sedangkan bahan yang
digunakan adalah aquadest dan garam dapur.
Langkah pertama yang harus dilakukan adalah mengukur suhu air dengan
thermometer, serta membuat larutan NaCl 0,5 M dengan cara melarutkan 30 gr garam dapur
ke dalam 1 L aquadest. Pemilihan variabel konsentrasi NaCl tersebut bertujuan untuk
menyamakan kondisi operasi dengan air laut. Konsentrasi NaCl dalam air laut adalah 3%
w/w, atau ekivalen dengan 0,51 M. Konversi satuan % massa menjadi molaritas ( M ) dapat
dilakukan dengan rumus berikut :
Laboratorium Teknik Kimia FTI-ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-3
dimana adalah densitas air laut ( gr/mL ), % adalah konsentrasi dalam persen, dan Mr adalah
massa molekul relatif zat terlarut ( gr/mol ). Kemudian selanjutnya adalah mengisi pipa difusi
dengan larutan NaCl hingga memenuhi sel difusi didalam pipa. Pasang pipa difusi pada
tangki. Setelah pipa difusi terpasang, tangki difusi diisi dengan 3 liter aquadest. Atur kembali
posisi pipa difusi hingga berada sejajar dengan permukaan aquadest. Celupkan probe / sensor
pengukur conductometer ke dalam tangki difusi, lalu hidupkan conductometer dan magnetic
stirrer. Atur kecepatan putaran magnetic stirrer sampai berputar. Konduktivitas aquadest di
dalam tangki difusi diukur selama 30 menit, serta perubahan nilai konduktivitas dicatat setiap
3 menit.
Nilai konduktivitas larutan ( ) yang terukur mengindikasikan bahwa terdapat ion
ion Na+ dan Cl- yang berpindah. Semakin tinggi nilai konduktivitas, maka semakin besar
konsentrasi NaCl di dalam tangki tersebut. Hubungan antara konduktivitas larutan dengan
konsentrasi dapat dinyatakan dalam persamaan berikut :
Keterangan :
= Konduktivitas molar elektrolit ( S m2/mol )
= Konduktivitas larutan elektrolit ( S/m )
CA = Konsentrasi garam elektrolit A ( mol/m3 )
Dengan menganggap konsentrasi NaCl pada air laut cukup encer, nilai tidak bergantung
pada konsentrasi NaCl ( = o ) dan dapat ditentukan dengan rumus berikut :
Dimana i adalah konduktivitas molar pembatas ion, yang telah ditabelkan pada suhu 25oC.
Nilai serta i tidak terlalu dipengaruhi oleh temperatur, sehingga pengaruh temperatur dapat
diabaikan.
( Setyawan, 2013, hal 212 216 )
Berdasarkan tabel diatas, maka dapat diketahui bahwa NaCl = 126,5 S cm2/mol, atau 0,01265
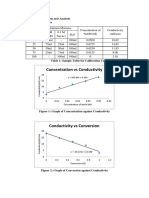
S m2/mol. Jika dibuat plot antara konsentrasi NaCl ( CA ) vs waktu ( t ), maka didapatkan
grafik sebagai berikut :
Laboratorium Teknik Kimia FTI-ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-4
CA
NaCl
t (menit)
Gambar III.2.1 Grafik Konsentrasi NaCl di Dalam Tangki Difusi Sebagai Fungsi Waktu Pada
0,5 M Percobaan Pertama
CA
NaCl
t (menit)
Gambar III.2.2 Grafik Konsentrasi NaCl di Dalam Tangki Difusi Sebagai Fungsi
Waktu Pada 0,5 M Percobaan Kedua
Laboratorium Teknik Kimia FTI-ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-5
CA
NaCl
t (menit)
Gambar III.2.3 Grafik Konsentrasi NaCl di Dalam Tangki Difusi Sebagai Fungsi Waktu Pada
Variabel 0.5 M Percobaan ketiga
Pada percobaan dengan menggunakan NaCl 0,5 M yang pertama, dapat terlihat
bahwa konsentrasi NaCl di dalam tangki difusi selama 30 menit mengalami peningkatan
cukup teratur, sehingga membentuk kurva yang cenderung linier. Hal ini disebabkan karena
gradien konsentrasi antara larutan NaCl 0,5 M di dalam pipa difusi dengan aquadest tidak
terlalu besar. Pada percobaan kedua dengan larutan NaCl 0,5 M. Konsentrasi NaCl yang
berdifusi ke dalam aquadest mengalami peningkatan yang cukup signifikan pada t = 15
hingga t = 18 menit, sehingga membentuk kurva polinomial derajat 2. Hal ini disebabkan
karena gradien konsentrasinya cukup besar. Sedangkan pada percobaan dengan larutan NaCl
0.5 M yang ketiga, kenaikan konsentrasi NaCl di dalam tangki difusi cukup beraturan, namun
terdapat kenaikan drastis pada t = 27 hingga t = 30. Hal yang cukup tidak ideal ini terjadi
karena mungkin NaCl yang kita gunakan selama satu praktikum mungkin telah
terkontaminasi sehingga menurunkan konduktivitas atau mungkin juga kualitas dari cairan
tersebut sehingga tidak akuratnya pembacaan angka konduktivitas pada conductometer.
Setelah didapatkan persamaan konsentrasi sebagai fungsi waktu, maka kita dapat menghitung
nilai koefisien difusivitas NaCl dengan rumus sebagai berikut :
Nilai koefisien difusivitas senyawa elektrolit encer dapat pula dihitung dengan
menggunakan persamaan Nernst Haskell sebagai berikut :
Laboratorium Teknik Kimia FTI-ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-6
dimana DoA koefisien difusivitas pada suhu 25oC dalam cm2/s, T adalah suhu larutan dalam oC,
n adalah valensi dari anion ( - ) dan kation ( + ), dan adalah konduktivitas molar pembatas
anion maupun kation. Untuk menghitung nilai DoA pada T 25oC, pertama tama hitunglah
DoA pada 25oC, kemudian kalikan dengan faktor koreksi, f, sebagai berikut :
Dimana T dalam satuan kelvin, serta w adalah viskositas air dalam satuan centipoise ( cp ).
Jika hasil eksperimen dibandingkan dengan nilai koefisien difusivitas menurut Persamaan
Nernst Haskell, akan diperoleh data sebagai berikut :
Tabel III.2.1 Perbandingan Nilai DA Secara Eksperimen dan Menurut Persamaan Empiris
Variabel Da Eksperimen (m2/s) Da Nernst-Haskell (m2/s) Error
0.5 M 1.11320 x 10-9 1.73472 x 10-9 35.8283%
0.5 M 5.6603 x 10-9 1.73472 x 10-9 226,2629%
0.5 M 2.8301 x 10-9 1.73472 x 10-9 63.14448%
Rata-rata 3.2012 x 10-9 1.73472 x 10-9 84.53699%
Terlihat jelas pada variabel NaCl 0,5 M yang pertama, memiliki error yang paling kecil jika
dibandingkan terhadap DA menurut Nernst Haskell, yakni sebesar 35,8283%.
( Geankoplis, 2003, hal 434 )
Berdasarkan hasil percobaan dan perhitungan, nilai koefisien difusivitas ( DA ) NaCl
adalah 1.11320 x 10-9m2/s, 5.6603 x 10-9m2/s pada percobaan kedua, 2.8301 x 10-9 m2/s pada
percobaan ketiga, sehingga didapatkan nilai rata rata 3.2012 x 10-9m2/s. Sedangkan menurut
persamaan empiris ( Persamaan Nernst - Haskell ), nilai koefisien difusivitas NaCl 1.73472 x
10-9m2/s.
Persamaan dasar untuk menyelesaikan persoalan ini dapat diturunkan dari neraca massa
NaCl dalam larutan :
Dengan memasukkan initial condition ( IC ) sebagai berikut,
t=0 CAo = Cair laut
CA = 0
Maka didapatkan persamaan berikut :
Laboratorium Teknik Kimia FTI-ITS
BAB III HASIL PERHITUNGAN DAN PEMBAHASAN III-7
Jika cuplikan sampel yang diambil sebanyak 1 liter ( = 1 kg/lt ), maka
didapatkan nilai = 1.684x 10-3 tahun. Sehingga untuk menaikkan konsentrasi dari 0
ppm menjadi 250 ppm ( 4,274 10-3 mol/liter ), waktu yang dibutuhkan dapat
dihitung :
t= 1.4088 x 10-5 tahun
Dengan menggunakan alat yang memiliki spesifikasi yang sama dengan percobaan di
laboratorium, maka untuk menaikkan konsentrasi dari 0 ppm menjadi 250 ppm
membutuhkan waktu selama 1.4088 x 10-5 tahun.
III.3 Rekomendasi
Dalam pengukuran koefisien difusivitas air laut pada skala besar, sebaiknya
melakukan kalibrasi yang berarturan dan menjaga kualitas sampel supaya menghindari error
yang besar
Laboratorium Teknik Kimia FTI-ITS
You might also like
- Resistant StarchDocument17 pagesResistant StarchIrham Hikmawan RamadhanNo ratings yet
- NO. Elements Page NoDocument21 pagesNO. Elements Page NoandriasNo ratings yet
- V2 (m/s) V1 (m/s) P1 (Pa) P2 (Pa) Q (m^3/h) fasumido v (m/s) Re fcalculado L (m) D (m) z1 (m) z2 (m) ε (m) RR=ε/D μ (kg/ (m*s) ) g (m/s^2) ρ (kg/m3) γ (N/m3) ν (m2/s)Document4 pagesV2 (m/s) V1 (m/s) P1 (Pa) P2 (Pa) Q (m^3/h) fasumido v (m/s) Re fcalculado L (m) D (m) z1 (m) z2 (m) ε (m) RR=ε/D μ (kg/ (m*s) ) g (m/s^2) ρ (kg/m3) γ (N/m3) ν (m2/s)DiegoAlexNo ratings yet
- Course: Soil Mechanics II Code: CVNG 2009 Lab: Consolidation Name: Adrian Rampersad I.D:809001425Document16 pagesCourse: Soil Mechanics II Code: CVNG 2009 Lab: Consolidation Name: Adrian Rampersad I.D:809001425Adrian Mufc RampersadNo ratings yet
- Tabel Hidrograf Inflow: Baiq Gita Aulia F1A019030Document6 pagesTabel Hidrograf Inflow: Baiq Gita Aulia F1A019030SUHARTINo ratings yet
- Baiq Gita AuliaDocument6 pagesBaiq Gita AuliaSUHARTINo ratings yet
- Traxial Test Lab Full ReportDocument14 pagesTraxial Test Lab Full ReportMohd Nik Harith Fawwaz100% (3)
- Ml/s X 0.1 N 0.0538 N: 0 NaohDocument2 pagesMl/s X 0.1 N 0.0538 N: 0 NaohNabilaFatinKamilasariNo ratings yet
- Rain Water Basin DesignDocument11 pagesRain Water Basin DesignSturza AnastasiaNo ratings yet
- Gas Absorption Lab ReportDocument12 pagesGas Absorption Lab ReportGracylla RoseNo ratings yet
- Lab Report - Determination of The Stability Constant of A Metal ComplexDocument18 pagesLab Report - Determination of The Stability Constant of A Metal ComplexValerie MangasarNo ratings yet
- Experiment No. 1 (CRE II - RTD MFR (Pulse) )Document6 pagesExperiment No. 1 (CRE II - RTD MFR (Pulse) )Prashant GiriNo ratings yet
- Lab#1 Fall2018Document8 pagesLab#1 Fall2018Qasim SafdarNo ratings yet
- Kelompok 6 - Assignment - 4Document7 pagesKelompok 6 - Assignment - 4Messa Adi SaputraNo ratings yet
- Data NormalDocument44 pagesData NormalJuancho TusinNo ratings yet
- Lab 6Document6 pagesLab 6Khuresh ShahNo ratings yet
- DataDocument18 pagesDataMohaiminNo ratings yet
- Concentration Vs Conductivity: 1.0 Results, Discussion and Analysis 1.1 Calibration CurveDocument9 pagesConcentration Vs Conductivity: 1.0 Results, Discussion and Analysis 1.1 Calibration CurveAhZaiSkyNo ratings yet
- Tabel Perhitungan Gambar Keruntuhan Muka 1ADocument9 pagesTabel Perhitungan Gambar Keruntuhan Muka 1Afajar sulaimanNo ratings yet
- Exercise. Sedimentation or Tickening.Document11 pagesExercise. Sedimentation or Tickening.Valeria cNo ratings yet
- Lab QADocument4 pagesLab QALeonardo YamashiroNo ratings yet
- TNLCD LabDocument9 pagesTNLCD LabtworedpartyhatsNo ratings yet
- QuizzzDocument16 pagesQuizzzfaidahNo ratings yet
- Analysis of Large Diameter Cyclone Plant Performance. Proc. 9th Aust. Coal Prep. Conf., Yeppoon, Oct. 2002 (Aust. Coal Prep - Soc.), 68-89Document22 pagesAnalysis of Large Diameter Cyclone Plant Performance. Proc. 9th Aust. Coal Prep. Conf., Yeppoon, Oct. 2002 (Aust. Coal Prep - Soc.), 68-89JD FCNo ratings yet
- Case Study 1Document22 pagesCase Study 1JD FCNo ratings yet
- Bernoulli 08 LabDocument20 pagesBernoulli 08 LabsdjdsfNo ratings yet
- A. Tabel Data PengmatanDocument4 pagesA. Tabel Data PengmatanAdinda NurNo ratings yet
- Book 1Document6 pagesBook 1Yuki KurniawanNo ratings yet
- 408 Exp 1Document14 pages408 Exp 1goabaone kgopaNo ratings yet
- EXCERCISEDocument4 pagesEXCERCISEHussen MohammedNo ratings yet
- Physics Lab Report - PendulumDocument8 pagesPhysics Lab Report - PendulumRyan SongNo ratings yet
- Determination of Critical Micelle ConcentrationDocument8 pagesDetermination of Critical Micelle ConcentrationthikamenituyeniNo ratings yet
- Ukom LatDocument4 pagesUkom LatTanti KharismatikaNo ratings yet
- 8/15/94 A-1 Niosh Manual of Analytical MethodsDocument1 page8/15/94 A-1 Niosh Manual of Analytical MethodsLuis Felipe Mera GrandasNo ratings yet
- Heat Exchanger ExperimentDocument21 pagesHeat Exchanger ExperimentKai Zun WongNo ratings yet
- Perhitungan Difusivitas IntegralDocument12 pagesPerhitungan Difusivitas IntegralamosagungNo ratings yet
- Non Electrolyte Solutes From Surface Tension ChangeDocument6 pagesNon Electrolyte Solutes From Surface Tension ChangethikamenituyeniNo ratings yet
- Flow Meter Orifice CalculationDocument27 pagesFlow Meter Orifice CalculationLaksono BudiNo ratings yet
- Timber Piles by KDocument3 pagesTimber Piles by KKamran AliNo ratings yet
- A - 3-4 Component DensitiesDocument5 pagesA - 3-4 Component Densitiesayisha.maharramovaNo ratings yet
- X vs. T 2: 1) Tablas de Tiempo Al Cuadrado Tabla 1 0 0,22 0,43 0,62 0,825 M 0 0,8336 1,685 2,471 3,323329 S 2Document6 pagesX vs. T 2: 1) Tablas de Tiempo Al Cuadrado Tabla 1 0 0,22 0,43 0,62 0,825 M 0 0,8336 1,685 2,471 3,323329 S 2kustNo ratings yet
- Laporan MixingDocument32 pagesLaporan Mixingrizal yahdyNo ratings yet
- Seawater PDFDocument2 pagesSeawater PDFHartinie MNo ratings yet
- Esterification of EthanolDocument15 pagesEsterification of EthanolSadia HasanNo ratings yet
- Bab Iv Hasil Dan Pembahasan: Rata-Rata 1 1 2 2Document4 pagesBab Iv Hasil Dan Pembahasan: Rata-Rata 1 1 2 2desvianadfNo ratings yet
- Convecção Forçada - G6Document9 pagesConvecção Forçada - G6Julia CellaNo ratings yet
- Hydrological and Hydraulic Analysis Example (1) .Xls AgutanDocument13 pagesHydrological and Hydraulic Analysis Example (1) .Xls AgutanKevin CondeNo ratings yet
- Tabel Pengamatan Modul 4Document5 pagesTabel Pengamatan Modul 4andryNo ratings yet
- Pengolahan Data H10 - Kelompok 07Document6 pagesPengolahan Data H10 - Kelompok 07Iqbal RoroaNo ratings yet
- Table Hydrometer TestDocument3 pagesTable Hydrometer TestSue JinsueNo ratings yet
- Flood Frequency Analysis Estimation of Design H.F.L. of River Tipkai AT RCC Bridge Khoraghat Gauge SiteDocument10 pagesFlood Frequency Analysis Estimation of Design H.F.L. of River Tipkai AT RCC Bridge Khoraghat Gauge SiteNILRATAN SARKARNo ratings yet
- Andrew Hamonangan Nadapdap B Module01Document22 pagesAndrew Hamonangan Nadapdap B Module01012 Andrew Hamonangan NadapdapNo ratings yet
- Data Praktikum Isoterm AdsorpsiDocument7 pagesData Praktikum Isoterm Adsorpsirudi salamNo ratings yet
- Lesson 3: Measure Moment Solid Object Inertia by Oscillation MethodDocument3 pagesLesson 3: Measure Moment Solid Object Inertia by Oscillation MethodLe Tung QuanNo ratings yet
- Lampiran A Laporan Sementara Ekstraksi Padat CairDocument2 pagesLampiran A Laporan Sementara Ekstraksi Padat CairRicky Putra SiregarNo ratings yet
- Principalele Caracteristici Ale Navei Şi Modelului Experimental Tabelul 1. Caracteristicile Navei Şi Ale Modelului ExperimentalDocument6 pagesPrincipalele Caracteristici Ale Navei Şi Modelului Experimental Tabelul 1. Caracteristicile Navei Şi Ale Modelului ExperimentalGenoveva StraticaNo ratings yet
- Problem SolutionDocument4 pagesProblem SolutionKarar AL-DahlkiNo ratings yet
- Fluids Laboratory Experiment (Friction Loss Along A Pipe)Document17 pagesFluids Laboratory Experiment (Friction Loss Along A Pipe)Chrionny AlumediNo ratings yet
- Estimativa de Propriedades de Óleos Vegetáis e Acidos Graxos 21.03.15.0Document87 pagesEstimativa de Propriedades de Óleos Vegetáis e Acidos Graxos 21.03.15.0Eng AlfNo ratings yet
- Enhanced Oil Recovery: Resonance Macro- and Micro-Mechanics of Petroleum ReservoirsFrom EverandEnhanced Oil Recovery: Resonance Macro- and Micro-Mechanics of Petroleum ReservoirsRating: 5 out of 5 stars5/5 (1)
- Wheat FlourDocument8 pagesWheat FlourIrham Hikmawan RamadhanNo ratings yet
- Lembar 1 Dari 3 HalamanDocument3 pagesLembar 1 Dari 3 HalamanIrham Hikmawan RamadhanNo ratings yet
- 013101367X TocDocument6 pages013101367X TocIrham Hikmawan RamadhanNo ratings yet
- Coll OidsDocument77 pagesColl OidsIrham Hikmawan RamadhanNo ratings yet