Professional Documents
Culture Documents
0 ratings0% found this document useful (0 votes)
30 viewsch2 4-Suivi D'une Transformation Chimique Activité
ch2 4-Suivi D'une Transformation Chimique Activité
Uploaded by
Rachid SadCh24
Copyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
You might also like
- يتفاعل الزنك مع محلول حمض الكبريتيكDocument1 pageيتفاعل الزنك مع محلول حمض الكبريتيكanon-774739100% (2)
- تتبع تطور تحول كيميائيDocument1 pageتتبع تطور تحول كيميائيmarouaneNo ratings yet
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- Exam 2021Document2 pagesExam 2021سمير دبيليNo ratings yet
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- 4- تتبع تحول كيميائيDocument10 pages4- تتبع تحول كيميائيMr GamerNo ratings yet
- درس التحول الكيميائى وحصيلة المادة جذع مشترك نموذج 1Document3 pagesدرس التحول الكيميائى وحصيلة المادة جذع مشترك نموذج 1dadesmohamed956No ratings yet
- Ø Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙDocument2 pagesØ Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙRiad ErENo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Composition de Physique 3AS - Sujet 05Document2 pagesComposition de Physique 3AS - Sujet 05Hasan RajawiNo ratings yet
- Exos BelkacemDocument4 pagesExos BelkacemMilia dyNo ratings yet
- Kanem U1Document1 pageKanem U1Alilou GuevarachéNo ratings yet
- Suivi TemporelDocument3 pagesSuivi Temporelmourafiq faysal100% (1)
- تمارين وحلول في الكيمياءDocument3 pagesتمارين وحلول في الكيمياءالغزيزال الحسن EL GHZIZAL Hassane88% (17)
- DPH DV: C H CoohDocument4 pagesDPH DV: C H Coohe.maskarNo ratings yet
- التوزنات الكيميائية و التحولات النووية 10Document1 pageالتوزنات الكيميائية و التحولات النووية 10YassineNo ratings yet
- 1 6Document5 pages1 6azizNo ratings yet
- التحولات ح,ق و الكهرباءDocument1 pageالتحولات ح,ق و الكهرباءYassine0% (1)
- SerieReac DjamelDocument1 pageSerieReac Djamelben amor melikaNo ratings yet
- Tamarind As - U7 - Oxred - 2023Document3 pagesTamarind As - U7 - Oxred - 2023Ma Ry100% (1)
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- 8Document2 pages8e.maskarNo ratings yet
- Révision BAC 2018Document172 pagesRévision BAC 2018ZineChini100% (5)
- Suivi Dune Transformation ChimiqueDocument2 pagesSuivi Dune Transformation ChimiqueZineb LazrakNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- Serie2as - U7 - Oxred - 2023Document3 pagesSerie2as - U7 - Oxred - 2023abdenouraitchikh27No ratings yet
- 2AS U07 - E3 - Cour-Exe 04Document7 pages2AS U07 - E3 - Cour-Exe 04Mariem Mari33% (3)
- BBL AbedDocument4 pagesBBL Abedعبد العزيز مروىNo ratings yet
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- 1975Document7 pages1975nounoussyanNo ratings yet
- سلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022Document7 pagesسلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022widad doudiNo ratings yet
- تقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيDocument2 pagesتقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيNa LineNo ratings yet
- 1.الدراسة الحركية لتفاعل عن طريق الموصليةDocument2 pages1.الدراسة الحركية لتفاعل عن طريق الموصليةBRAHIMdeSAFINo ratings yet
- سلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021Document16 pagesسلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021سمير دبيليNo ratings yet
- Bbl13 BouzidDocument7 pagesBbl13 Bouzidcylia ciciNo ratings yet
- Examen2 smb1Document2 pagesExamen2 smb1Amine AlaoUii AlaouiNo ratings yet
- BAC23 Doc1Document2 pagesBAC23 Doc1Sekkoum AhmedNo ratings yet
- 3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTDocument5 pages3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTe.maskarNo ratings yet
- سلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيDocument10 pagesسلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيTarakk KaziNo ratings yet
- Dzexams Docs 3as 907353Document17 pagesDzexams Docs 3as 907353Abderrahmane henniNo ratings yet
- أهم التعاريف ا+ المتابعة+ملخص+ مخطط PDFDocument4 pagesأهم التعاريف ا+ المتابعة+ملخص+ مخطط PDFAmoula HayatieNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Soumia KerdNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Hina BouzerzourNo ratings yet
- السلسلة 4Document2 pagesالسلسلة 4Sami RabhiNo ratings yet
- المتفوق 01 by DEBILI Samir Lycee Malek Bennabi TEBESSADocument1 pageالمتفوق 01 by DEBILI Samir Lycee Malek Bennabi TEBESSAAmdjed BahaaNo ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)
- تمرين حول حجم غاز,Document2 pagesتمرين حول حجم غاز,Achref SaidNo ratings yet
- Composition de Physique 3AS - Sujet 01Document2 pagesComposition de Physique 3AS - Sujet 01Hasan Rajawi100% (1)
- Ø Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙDocument7 pagesØ Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙZi vinNo ratings yet
- تمرين في الناقلية مع الحلDocument4 pagesتمرين في الناقلية مع الحلferiel taibiNo ratings yet
- الوحدة 01 السلسلة 01Document3 pagesالوحدة 01 السلسلة 01Manil FélixNo ratings yet
- الإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةDocument6 pagesالإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةMohamedElKatarNo ratings yet
- ExamsDocument1 pageExamsyacine yacineNo ratings yet
- تمارين تتبع تطور تحول كيميائي أولى باك النموذج1Document12 pagesتمارين تتبع تطور تحول كيميائي أولى باك النموذج1yahya elbahieNo ratings yet
- Examens Nationaux 2bac Science PC 2015 RattrapageDocument14 pagesExamens Nationaux 2bac Science PC 2015 Rattrapagebadia ben abdellahNo ratings yet
- E2 2-Energie Potentielle ÉlectrostatiqueDocument2 pagesE2 2-Energie Potentielle ÉlectrostatiqueRachid SadNo ratings yet
- ch2 9-La Chimie Organique Et Son Omniprésence ActivitéDocument2 pagesch2 9-La Chimie Organique Et Son Omniprésence ActivitéRachid SadNo ratings yet
- ch2 6-Les Réactions Acido-Basiques ActivitéDocument2 pagesch2 6-Les Réactions Acido-Basiques ActivitéRachid SadNo ratings yet
- تضمين الوسع (2) soutienDocument2 pagesتضمين الوسع (2) soutienRachid Sad100% (2)
- تضمين الوسع (2) soutien PDFDocument2 pagesتضمين الوسع (2) soutien PDFRachid SadNo ratings yet
- الموجات-الضوئية-سلسسلة-تمارين 1Document1 pageالموجات-الضوئية-سلسسلة-تمارين 1Rachid SadNo ratings yet
- تمارين 4 التناقص الإشعاعيDocument3 pagesتمارين 4 التناقص الإشعاعيRachid SadNo ratings yet
- c1 2sc Continuite ResDocument1 pagec1 2sc Continuite ResRachid SadNo ratings yet
- c1 2sc Continuite Res PDFDocument1 pagec1 2sc Continuite Res PDFRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- Serie 1 1erbac MvrotDocument1 pageSerie 1 1erbac MvrotRachid SadNo ratings yet
- Serie 1 1erbac MvrotDocument1 pageSerie 1 1erbac MvrotRachid SadNo ratings yet
- الموجات-الضوئية-سلسسلة-تمارين 1Document1 pageالموجات-الضوئية-سلسسلة-تمارين 1Rachid Sad100% (1)
ch2 4-Suivi D'une Transformation Chimique Activité
ch2 4-Suivi D'une Transformation Chimique Activité
Uploaded by
Rachid Sad0 ratings0% found this document useful (0 votes)
30 views2 pagesCh24
Original Title
ch2 4-Suivi d'une transformation chimique Activité
Copyright
© © All Rights Reserved
Available Formats
DOC, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCh24
Copyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
Download as doc, pdf, or txt
0 ratings0% found this document useful (0 votes)
30 views2 pagesch2 4-Suivi D'une Transformation Chimique Activité
ch2 4-Suivi D'une Transformation Chimique Activité
Uploaded by
Rachid SadCh24
Copyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
Download as doc, pdf, or txt
You are on page 1of 2
تتبع تحول كيميائي
Solutions électrolytiques et concentrations
-1تطور مجموعة خالل تحول كيميائي
Evolution d’u, ensemble au cours d’une transformation chimique
ON
) qa
(3
gA
) qa
( محلول Cنترات الفضة
) qa
( نضيف إلى محلول كلورور الصوديوم ) qa(
aN
فنحصل على راسب أبيض لكلورور الفضة الذي يسود تحت تأثير الضوء.
-1حدد المجموعة الكيميائية.
-2أذكر مفهوم التحول الكيميائي.
-3حدد المتفاعالت والنواتج.
-4أكتب معادلة التفاعل (نمذجة التفاعل الكيميائي).
-5حدد األنواع الكيميائية الموجودة في الحالة البدئية والحالة
النهائية(بافتراض أن أيونات الفضة وأيونات الكلور تفاعلتا كليا).
-2تطور كميات المادة لألنواع الكيميائية أثنا تحول كيميائي
Evolution des quantités de matière des entités chimiques au cours d’une transformation chimique
2-1تقدم التفاعل (تذكير)
تقدم التفاعل ،مقدار يرمز له بالحرف ،xويعبر عنه بالمول ويمكن من تتبع تطور كميات
المادة لألنواع الكيميائية المكونة لمجموعة أثناء تحول كيميائي انطالقا من معرفة
كميات المادة البدئية للمتفاعالت.
CcاختفاءDd عامة
يرافق Bb Aa
بصفة نعتبر التفاعل العام التالي:
ax moمن النوع Aواختفاء bx moمن النوع ،Bتكون cx moمن النوع Cوتكون dx
moمن النوع .D
2-2الجدول الوصفي لتفاعل
لتتبع تطور كيميائي ينبغي إنشاء الجدول الوصفي باستعمال تقدم التفاعل:
Cc Bb
Aa معادلة التفاعل
كميات المادة ()mo حالة المجموعة التقدم )x(mo
)ni(A )ni(B )ni(C )ni(D 0 اليدئة
ni(A)-ax ni(B)-bx ni(C)+cx ni(D)+dx x خالل التحول
) ni(Xتمثل كمية مادة النوع الكيميائي Xفي الحالة البدئية.
أيونات om
الكالسيوم n i 2600منaC
,0 ننجز ترسيب فوسفات الكالسيوم بمزج كمية
om
الفوسفات ،أنشئ الجدول الوصفي لهذا التفاعل. nمنOP
أيونات i 3
,0
200
4 وكمية
2-3المتفاعل المحد للتفاعل
عند الحالة النهائية للتفاعل يتوقف التفاعل عن التطور ويكون التقدم قصويا xmax
وذلك عند نفاذ أحد المتفاعالت نقول إنه المتفاعل المحد.نعتبر التفاعل
السابق(ترسيب فوسفات الكالسيوم).
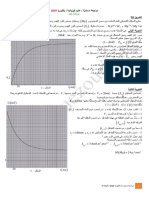
3
-1أرسم تغيرات كمية مادة aC ) qa2(
وكمية مادة OP) (4qa
بداللة التقدم .x
2
) aC
هو المتفاعل المحد أحسب التقدم األقصى .xmax1 qa
( -2بافتراض أن
3
-3بافتراض أن OP) (4qa
هو المتفاعل المحد أحسب التقدم األقصى .xmax2
-4استنتج المتفاعل المحد.
-5أحسب كميات مادة المتفاعالت والنواتج عند نهاية التفاعل(هذا ما يسمى حصيلة
المادة).
-6ننجز نفس الترسيب باستعمال نفس كمية مادة المتفاعل المحد ،ونغير كمية
المتفاعل الثاني ،أحسب كمية مادة هذا المتفاعل لكي يختفي كل المتفاعالت بعد
نهاية التفاعل ،استنتج في هذه الحالة العالقة بين كمية مادة المتفاعالت
والنواتج والمعامالت التناسبية .نقول في هذه الحالة إن الخليط
استيكيومتري.
-3تتبع تحول كيميائي ينتج غازات
3-1توقع الحجم النهائي لغاز ينتج عن تفاعل كيميائي عند درجة حرارة
وضغط ثابتين
ننجز التركيب التجريبي المبين في الشكل جانبه،
أ .حمــيد بوعــالم 15 الكيمياء :4تتبع تحول كيميائي
حيث نضع في القنينة حبيبات الزنك كتلتها m=0,11g
نصب حمض الكلوريدريك الموجود في القمع ببطئ
(الشكل أ) .ينتج عن التفاعل انطالق غاز H2
الذي نمرره في المخبر المدرج وأيونات .+Zn2في
نهاية التفاعل ال يبقى الزنك .نترك الجميع يبرد
لتصبح درجة وسط التفاعل هي درجة حرارة المختبر
، 02 Cولمعرفة ضغط الغاز نقوم بالتجربة
الممثلة في الشكل ب :نحرك المخبر حتى يصبح
مستوى الماء فيه هو نفس مستوى الماء الموجود
في الكأس ،وهكذا نحصل على ضغط الغاز مساويا
للضغط الجوي الموجود في المختبر .p=1,023.105Paحجم غاز ثنائي الهيدروجين المحصل
04 Lm 2pxe
V H
. عليه تجريبيا هو
-1أكتب معادلة التفاعل.
-2أحسب كمية مادة الزنك المستعمل.
-3أنشئ الجدول الوصفي للتفاعل بدون حساب O H .n i 3
-4حدد المتفاعل المحد .ثم استنتج قيمة التقدم األقصى.
. C50 ,0
استنتجL om
حجمه الالزم لهذا -5إذا علمت أن تركيز حمض الكلوريدريك هو 1
التفاعل.
-6باعتبار غاز ثنائي الهيدروجين المتكون غازا كامال في ظروف التجربة ،استنتج
V Hبداللة xmaxو Tو ،pأحسب قيمته ،قارن بين هذه النتيجة تعبير حجم 2
المتوقعة نظريا مع نتائج التجربة.
المعطيات M(Zn)=65,4g.mo-1 :و.R=8,314S.I
3-2توقع الضغط النهائي لغاز ينتج عن تفاعل كيميائي عند درجة حرارة وحجم
ثابتين
ننجز التركيب التجريبي المبين في الشكل جانبه،
نضع داخل حوجلة سعتها 500mL، 50mLمن حمض
الكبريتيك بتركيز ،1 1
. L om
ونعلق بواسطة سلك
نحاسي كتلة m=3,6mgمن المغنيزيوم .نسجل درجة
وقيمة الضغط الجويحرارة المحيط نجد 02 C
.pi=1,023.105Paنغلق الحوجلة ثم نحركها ليسقط
المغنيزيوم فيحدث تفاعل ينطلق فيه غاز ثنائي
الهيدروجين ويتحول المغنيزيوم Mgإلى ،+Mg2
نسجل قيمة الضغط النهائي بعد أن ترجع درجة حرارة الوسط إلى درجة الحرارة البدئية
aP p p H .p 2pxe
i m 01.1,8 3
فنجد قيمة ضغط غاز ثنائي الهيدروجين هي:
-1أكتب معادلة التفاعل.
-2أحسب كمية مادة المتفاعالت في الحالة البدئية.
-3أنشئ الجدول الوصفي للتفاعل.
-4حدد المتفاعل المحد.
-5باعتبار غاز ثنائي الهيدروجين المتكون غازا كامال في ظروف التجربة ،أوجد
تعبير الضغط H p 2
بداللة التقدم القصوي xmaxوحجمه ) V(H2و ،Tأحسب قيمة هذا
الضغط وقارن هذه القيمة مع تلك المحصل عليه تجريبيا.
المعطيات M(Mg)=24g.mo-1 :وR=8,314S.I
أ .حمــيد بوعــالم 16 الكيمياء :4تتبع تحول كيميائي
You might also like
- يتفاعل الزنك مع محلول حمض الكبريتيكDocument1 pageيتفاعل الزنك مع محلول حمض الكبريتيكanon-774739100% (2)
- تتبع تطور تحول كيميائيDocument1 pageتتبع تطور تحول كيميائيmarouaneNo ratings yet
- تمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFDocument6 pagesتمارينات المتابعة الزمنية لتحول كيميائي للأستاذ التيجاني دهام PDFAmine ChettafNo ratings yet
- Exam 2021Document2 pagesExam 2021سمير دبيليNo ratings yet
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- 4- تتبع تحول كيميائيDocument10 pages4- تتبع تحول كيميائيMr GamerNo ratings yet
- درس التحول الكيميائى وحصيلة المادة جذع مشترك نموذج 1Document3 pagesدرس التحول الكيميائى وحصيلة المادة جذع مشترك نموذج 1dadesmohamed956No ratings yet
- Ø Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙDocument2 pagesØ Ø Ù Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø Ù Ø© Ø Ù Ø Ø Ù ÙRiad ErENo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Composition de Physique 3AS - Sujet 05Document2 pagesComposition de Physique 3AS - Sujet 05Hasan RajawiNo ratings yet
- Exos BelkacemDocument4 pagesExos BelkacemMilia dyNo ratings yet
- Kanem U1Document1 pageKanem U1Alilou GuevarachéNo ratings yet
- Suivi TemporelDocument3 pagesSuivi Temporelmourafiq faysal100% (1)
- تمارين وحلول في الكيمياءDocument3 pagesتمارين وحلول في الكيمياءالغزيزال الحسن EL GHZIZAL Hassane88% (17)
- DPH DV: C H CoohDocument4 pagesDPH DV: C H Coohe.maskarNo ratings yet
- التوزنات الكيميائية و التحولات النووية 10Document1 pageالتوزنات الكيميائية و التحولات النووية 10YassineNo ratings yet
- 1 6Document5 pages1 6azizNo ratings yet
- التحولات ح,ق و الكهرباءDocument1 pageالتحولات ح,ق و الكهرباءYassine0% (1)
- SerieReac DjamelDocument1 pageSerieReac Djamelben amor melikaNo ratings yet
- Tamarind As - U7 - Oxred - 2023Document3 pagesTamarind As - U7 - Oxred - 2023Ma Ry100% (1)
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- 8Document2 pages8e.maskarNo ratings yet
- Révision BAC 2018Document172 pagesRévision BAC 2018ZineChini100% (5)
- Suivi Dune Transformation ChimiqueDocument2 pagesSuivi Dune Transformation ChimiqueZineb LazrakNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- Serie2as - U7 - Oxred - 2023Document3 pagesSerie2as - U7 - Oxred - 2023abdenouraitchikh27No ratings yet
- 2AS U07 - E3 - Cour-Exe 04Document7 pages2AS U07 - E3 - Cour-Exe 04Mariem Mari33% (3)
- BBL AbedDocument4 pagesBBL Abedعبد العزيز مروىNo ratings yet
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- 1975Document7 pages1975nounoussyanNo ratings yet
- سلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022Document7 pagesسلسلة الأكسدة والإرجاع مع الحلول المفصلة - الأستاذ كريم سني 2022widad doudiNo ratings yet
- تقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيDocument2 pagesتقويم الوحدة 01 المتابعة الزمينة لتحول كيميائيNa LineNo ratings yet
- 1.الدراسة الحركية لتفاعل عن طريق الموصليةDocument2 pages1.الدراسة الحركية لتفاعل عن طريق الموصليةBRAHIMdeSAFINo ratings yet
- سلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021Document16 pagesسلسلة تمارين وحدة المتابعة الزمنية لتحول كيميائي في الفيزياء للسنة الثالثة ثانوي الشعب العلمية 2020 - 2021سمير دبيليNo ratings yet
- Bbl13 BouzidDocument7 pagesBbl13 Bouzidcylia ciciNo ratings yet
- Examen2 smb1Document2 pagesExamen2 smb1Amine AlaoUii AlaouiNo ratings yet
- BAC23 Doc1Document2 pagesBAC23 Doc1Sekkoum AhmedNo ratings yet
- 3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTDocument5 pages3(s) 3 + (Aq) 2+ (Aq) 2 (G) 2 (L) - 2: DP DTe.maskarNo ratings yet
- سلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيDocument10 pagesسلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيTarakk KaziNo ratings yet
- Dzexams Docs 3as 907353Document17 pagesDzexams Docs 3as 907353Abderrahmane henniNo ratings yet
- أهم التعاريف ا+ المتابعة+ملخص+ مخطط PDFDocument4 pagesأهم التعاريف ا+ المتابعة+ملخص+ مخطط PDFAmoula HayatieNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Soumia KerdNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Hina BouzerzourNo ratings yet
- السلسلة 4Document2 pagesالسلسلة 4Sami RabhiNo ratings yet
- المتفوق 01 by DEBILI Samir Lycee Malek Bennabi TEBESSADocument1 pageالمتفوق 01 by DEBILI Samir Lycee Malek Bennabi TEBESSAAmdjed BahaaNo ratings yet
- Compo3Prem SoumiaDocument3 pagesCompo3Prem SoumiaManou100% (1)
- تمرين حول حجم غاز,Document2 pagesتمرين حول حجم غاز,Achref SaidNo ratings yet
- Composition de Physique 3AS - Sujet 01Document2 pagesComposition de Physique 3AS - Sujet 01Hasan Rajawi100% (1)
- Ø Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙDocument7 pagesØ Ù Ø Ø Ù Ù Ø Ù Ù Ù Ø Ø Ø Ø© Ø Ù Ù Ù Ù Ø© Ù Ø Ø Ù Ù Ù Ù Ù Ù Ø Ø ÙZi vinNo ratings yet
- تمرين في الناقلية مع الحلDocument4 pagesتمرين في الناقلية مع الحلferiel taibiNo ratings yet
- الوحدة 01 السلسلة 01Document3 pagesالوحدة 01 السلسلة 01Manil FélixNo ratings yet
- الإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةDocument6 pagesالإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةMohamedElKatarNo ratings yet
- ExamsDocument1 pageExamsyacine yacineNo ratings yet
- تمارين تتبع تطور تحول كيميائي أولى باك النموذج1Document12 pagesتمارين تتبع تطور تحول كيميائي أولى باك النموذج1yahya elbahieNo ratings yet
- Examens Nationaux 2bac Science PC 2015 RattrapageDocument14 pagesExamens Nationaux 2bac Science PC 2015 Rattrapagebadia ben abdellahNo ratings yet
- E2 2-Energie Potentielle ÉlectrostatiqueDocument2 pagesE2 2-Energie Potentielle ÉlectrostatiqueRachid SadNo ratings yet
- ch2 9-La Chimie Organique Et Son Omniprésence ActivitéDocument2 pagesch2 9-La Chimie Organique Et Son Omniprésence ActivitéRachid SadNo ratings yet
- ch2 6-Les Réactions Acido-Basiques ActivitéDocument2 pagesch2 6-Les Réactions Acido-Basiques ActivitéRachid SadNo ratings yet
- تضمين الوسع (2) soutienDocument2 pagesتضمين الوسع (2) soutienRachid Sad100% (2)
- تضمين الوسع (2) soutien PDFDocument2 pagesتضمين الوسع (2) soutien PDFRachid SadNo ratings yet
- الموجات-الضوئية-سلسسلة-تمارين 1Document1 pageالموجات-الضوئية-سلسسلة-تمارين 1Rachid SadNo ratings yet
- تمارين 4 التناقص الإشعاعيDocument3 pagesتمارين 4 التناقص الإشعاعيRachid SadNo ratings yet
- c1 2sc Continuite ResDocument1 pagec1 2sc Continuite ResRachid SadNo ratings yet
- c1 2sc Continuite Res PDFDocument1 pagec1 2sc Continuite Res PDFRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- حالة توازن و التحولات النوويةDocument2 pagesحالة توازن و التحولات النوويةRachid SadNo ratings yet
- Serie 1 1erbac MvrotDocument1 pageSerie 1 1erbac MvrotRachid SadNo ratings yet
- Serie 1 1erbac MvrotDocument1 pageSerie 1 1erbac MvrotRachid SadNo ratings yet
- الموجات-الضوئية-سلسسلة-تمارين 1Document1 pageالموجات-الضوئية-سلسسلة-تمارين 1Rachid Sad100% (1)