Professional Documents
Culture Documents
Halogeni Elementi
Halogeni Elementi
Uploaded by
Volim ČokoladuCopyright:
Available Formats
You might also like
- Kemija Petreski SeverDocument234 pagesKemija Petreski SeverVolim Čokoladu100% (5)
- 17 Skupina (Halogeni Elementi)Document12 pages17 Skupina (Halogeni Elementi)MatovilkicaNo ratings yet
- NemetaliDocument19 pagesNemetaliAnka Jurić100% (1)
- Ako Su Poznati Reaktanti Kemijske Reakcije Mogu Se PredvidjeDocument4 pagesAko Su Poznati Reaktanti Kemijske Reakcije Mogu Se PredvidjeLea MuzekNo ratings yet
- Domaća Zadaća-17. SkupinaDocument4 pagesDomaća Zadaća-17. SkupinaLeopold MacukicNo ratings yet
- Halogeni ElementiDocument3 pagesHalogeni ElementiIvan SkorupanNo ratings yet
- 1.elementi Na Koje NeDocument8 pages1.elementi Na Koje Neazur0301No ratings yet
- Spojevi Halogenih ElemenataDocument3 pagesSpojevi Halogenih ElemenataVolim ČokoladuNo ratings yet
- Halogeni ElementiDocument14 pagesHalogeni ElementiNaidaNo ratings yet
- Halkogeni Elementi - Skripta, 4. Razred Srednje ŠkoleDocument5 pagesHalkogeni Elementi - Skripta, 4. Razred Srednje ŠkolePaolaNo ratings yet
- VodikDocument2 pagesVodikVolim ČokoladuNo ratings yet
- KEMIJSKE PROMJENE I SVOJSTVA TVARI-za TeamsDocument9 pagesKEMIJSKE PROMJENE I SVOJSTVA TVARI-za TeamsWin GamerNo ratings yet
- HCL (G) + H2O (L) H3O+ (Aq) + CL - (Aq) : CH Cooh (Aq) +H2O (L) CH Coo - (Aq) +H O+ (Aq) Ch3Cooh (Aq) CH Coo + HDocument3 pagesHCL (G) + H2O (L) H3O+ (Aq) + CL - (Aq) : CH Cooh (Aq) +H2O (L) CH Coo - (Aq) +H O+ (Aq) Ch3Cooh (Aq) CH Coo + HLucija CrljenkoNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2014 LjetoDocument23 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2014 LjetoIvana05No ratings yet
- VodikDocument4 pagesVodikNina Stanic100% (1)
- Halogeni Elemeti PonavljanjeDocument19 pagesHalogeni Elemeti PonavljanjeTamara Tkalec-CarNo ratings yet
- Plemeniti PlinoviDocument54 pagesPlemeniti PlinoviStjepan Mađaroš100% (1)
- 2.4. Kemijska Svojstva Alkana I HalogenoalkanaDocument17 pages2.4. Kemijska Svojstva Alkana I HalogenoalkanaNikolina CibaricNo ratings yet
- I Analitička Grupa KatjonaDocument10 pagesI Analitička Grupa KatjonaBojana PotparićNo ratings yet
- I Analitička Grupa KatjonaDocument10 pagesI Analitička Grupa KatjonaBojana PotparićNo ratings yet
- Alkalijski I Zemnoalkalijski MetaliDocument3 pagesAlkalijski I Zemnoalkalijski MetaliMarijana ArbunićNo ratings yet
- Brom, Jod, Važniji Spojevi Halogenih ElemenataDocument11 pagesBrom, Jod, Važniji Spojevi Halogenih ElemenataMario IlićNo ratings yet
- 18 Grupa PseDocument4 pages18 Grupa PseAmna SpahićNo ratings yet
- Alkalijski Zemnoalk MetaliDocument18 pagesAlkalijski Zemnoalk MetaliMartina BrkljačaNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 LjetoDocument27 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 Ljetolana.nofaceNo ratings yet
- Spojevi Sa Kisikom I Derivati 01Document83 pagesSpojevi Sa Kisikom I Derivati 01Tomislav CvrtnjakNo ratings yet
- HALKOGENI ELEMENTI - BezDocument27 pagesHALKOGENI ELEMENTI - BezTamara Tkalec-CarNo ratings yet
- 10 - Kiseline I BazeDocument19 pages10 - Kiseline I BazeGusic SalkoNo ratings yet
- Dušikova Skupina ElemenataDocument6 pagesDušikova Skupina ElemenataKatarina BrboraNo ratings yet
- Halkogeni ElementiDocument7 pagesHalkogeni ElementiZvezda NasilnicaNo ratings yet
- ZivaDocument5 pagesZivaRiki BebiNo ratings yet
- Kemijska Svojstva AlkanaDocument10 pagesKemijska Svojstva AlkanaMery LilićNo ratings yet
- Novo Organska Kemija PonavljanjeDocument81 pagesNovo Organska Kemija Ponavljanjestoja.marin12No ratings yet
- Aldehidi I KetoniDocument2 pagesAldehidi I KetoniZanki KatarinaNo ratings yet
- Vjezba 3Document14 pagesVjezba 3emanuelNo ratings yet
- Halogeni Elementi-Grupni RadDocument20 pagesHalogeni Elementi-Grupni RadmarioNo ratings yet
- Elektroliza1 FRDocument11 pagesElektroliza1 FRpasitokogasitopitoNo ratings yet
- Halogenirani UgljikovodiciDocument6 pagesHalogenirani UgljikovodiciksivankaNo ratings yet
- Alkalni MetaliDocument22 pagesAlkalni MetalibelmaNo ratings yet
- Alkalni MetaliDocument34 pagesAlkalni MetaliAmila Ljubovic100% (1)
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008Document24 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008marija kusturaNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2013 JesenDocument24 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2013 JesenIvana05100% (1)
- HALOGENALKANIDocument40 pagesHALOGENALKANIMery LilićNo ratings yet
- 2 Metali PDFDocument67 pages2 Metali PDFMaria LyonsNo ratings yet
- Tehnički Važni MetaliDocument6 pagesTehnički Važni MetaliKarlo Vrančić100% (1)
- Oksidacijski Broj I TDDocument17 pagesOksidacijski Broj I TDAidaTravančićNo ratings yet
- DušikDocument5 pagesDušikZorica ManojlovicNo ratings yet
- Periodičnost Kemijskih Svojstava ElemenataDocument24 pagesPeriodičnost Kemijskih Svojstava ElemenataJust FortniteNo ratings yet
- 1 Aldehidi I Ketoni PDFDocument36 pages1 Aldehidi I Ketoni PDFAnonymous FVvteEHiDONo ratings yet
- 2.3 KloridiDocument12 pages2.3 KloridiMarija PiškorNo ratings yet
- Kemijski Udzbenik SoliDocument24 pagesKemijski Udzbenik Solibotoks uwuNo ratings yet
- VODIKDocument2 pagesVODIKDomagoj PokrovacNo ratings yet
- Kemijske Promjene 2024Document5 pagesKemijske Promjene 2024Martin VidovicNo ratings yet
- KEM4 - RL - Kemijska Analiza Organskih SpojevaDocument6 pagesKEM4 - RL - Kemijska Analiza Organskih SpojevaHana HorvatNo ratings yet
- P3-Aldehidi I KetoniDocument79 pagesP3-Aldehidi I KetoniVladimir StankovićNo ratings yet
- Ugljikova Skupina ElemenataDocument2 pagesUgljikova Skupina ElemenatakekemanxNo ratings yet
- VodikDocument2 pagesVodikVolim ČokoladuNo ratings yet
- Tehnički Važni MetaliDocument2 pagesTehnički Važni MetaliVolim ČokoladuNo ratings yet
- Spojevi Halogenih ElemenataDocument3 pagesSpojevi Halogenih ElemenataVolim ČokoladuNo ratings yet
- Standardni Elektrodni PotencijalDocument2 pagesStandardni Elektrodni PotencijalVolim ČokoladuNo ratings yet
- Viskoznost, Napetost Površine I Miješanje TekućinaDocument5 pagesViskoznost, Napetost Površine I Miješanje TekućinaVolim ČokoladuNo ratings yet
- Vrste Kemijskih VezaDocument3 pagesVrste Kemijskih VezaVolim Čokoladu100% (1)
- Vrste Entalpijskih Reakcija I Hessov ZakonDocument12 pagesVrste Entalpijskih Reakcija I Hessov ZakonVolim Čokoladu100% (1)
- 2010 09 Jdbe Kem Reak RedoxiDocument6 pages2010 09 Jdbe Kem Reak RedoxiVolim ČokoladuNo ratings yet
Halogeni Elementi
Halogeni Elementi
Uploaded by
Volim ČokoladuOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Halogeni Elementi
Halogeni Elementi
Uploaded by
Volim ČokoladuCopyright:
Available Formats
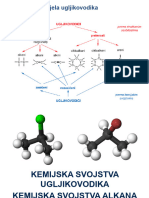
HALOGENI ELEMENTI
Elementi 17. Skupine nazivaju se halogeni elementi. Astat i tenesin su
radioaktivni elementi i njihova kemijska i fizikalna svojstva nisu poznata, nego se
pretpostavljaju na temelju sličnosti elemenata kroz skupinu.
Halogeni elementi imaju elektronsku konfiguraciju valentne ljuske ns2np5 I pri
sobnoj temperaturi su svi diatomarne molekule općenite formule X2 (F2, Cl2, Br2, I2).
Fluor je svijetložuti plin, klor je žutozeleni plin, brom crvenosmeđa tekućina, a jod
čvrsta ljubičasta kristalna tvar.
Različita agregacijska stanja posljedica su slabih van der Waalsovih sila koje djeluju
među molekulama halogena. S obzirom da kroz skupinu odozgo prema dolje raste
protonski broj, odnosno povećava se radijus atoma, a time i molekule halogena,
raste i jakost privlačnih sila te se mijenja agregacijsko stanje tvari.
SVOJSTVA, DOBIVANJE I UPOTREBA HALOGENIH ELEMENATA:
FLUOR:
Fluor je svijetložut plin oštra i prodorna mirisa te otrovan. Najelektronegativniji je
element i najmanjeg radijusa te s obzirom na konfiguraciju valentne ljuske vrlo je
reaktivan. Nedostaje mu jedan elektron to okteta, pa vrlo lako reagira s alkalijskim
metalima. U spojevima je uglavnom negativnog stupnja oksidacije (-I). Proizvodi se
anodnom oksidacijom otopine KF u bezvodnom HF, a primjenu nalazi u proizvodnji
nuklearnog goriva.
KLOR:
Klor je žutozeleni plin oštra i bockava mirisa. Vrlo je sličnih svojstva kao fluor te je
izrazito reaktivan i spaja se s većinom elemenata osim s C, O, N i plemenitim
plinovima. Klor je jako oksidacijsko sredstvo i u reakciji s halogenim elementima
oksidira sve halogene ispod sebe u skupini, pa se koristi u reakciji dobivanja ovih
elemenata.
Reakcije istiskivanja:
Cl2(g) + 2I-(aq) ->I2(aq) + Cl-(aq)
Zbog opadanja elektronegativnosti, elektronegativniji element u skupini istiskuje iz
spojeva element ispod njega u grupi.
Topljiv je u vodi i s reagira s vodom pri čemu nastaje klorna voda(smjesa klora,
klorovodične kiseline i hipokloraste kiseline). U ovoj reakciji dolazi do istovremene
oksidacije i redukcije na istoj tvari što se naziva reakcija disproporcioniranja:
Cl2(aq) + H2O(l) ->HClO (aq) + H+(aq) + Cl-(aq)
Klor se industrijski dobiva elektrolizom vodene otopine ili taljevine natrijeva klorida,
a laboratorijski reakcijom klorovodične kiseline i kalijeva permanganata ili
manganova (IV) oksida:
2KMnO4(s) + 16HCl(aq) -> 5Cl2(g) +2MnCl2(aq)+2KCl(aq)+8H2O(l)
Klor se koristi u industriji plastični polimera (PVC), otapala i pesticida. I tekstilnoj i
industriji papira koristi se kao sredstvo za izbjeljivanje te kao dezinfekcijsko
sredstvo za vodu za piće.
BROM:
Brom je korozivna, crvenosmeđa tekućina oštra mirisa koji se laboratorijski dobiva
reakcijom istiskivanja s klorom:
Cl2(g) + 2Br-(aq) ->Br2(aq) + Cl-(aq)
Koristi se u industriji za različite organske sinteze, a njegova sol, srebrov bromid,
za izradu fotografske emulzije.
JOD:
Jod je ljubičasta kristalna tvar koja se dobiva iz slane vode iz naftnih bušotina gdje
se također dobiva reakcijom istiskivanja s klorom:
Cl2(g) + 2I-(aq) ->I2(aq) + Cl-(aq)
Otopina joda i kalijeva jodida koristi se kao antiseptičko sredstvo (jodna tinktura), a
sam jod je esencijalni element koji je potreban za sintezu tiroksina (hormon
štitnjače). Nedostatak tirozina uzrokuje hipotireozu, odnosno smanjen rad štitnjače.
S obzirom da joda u namirnicama ima premalo, on se dodaje u kuhinjsku sol u
obliku kalijeva jodida ili kalijeva jodata.
You might also like
- Kemija Petreski SeverDocument234 pagesKemija Petreski SeverVolim Čokoladu100% (5)
- 17 Skupina (Halogeni Elementi)Document12 pages17 Skupina (Halogeni Elementi)MatovilkicaNo ratings yet
- NemetaliDocument19 pagesNemetaliAnka Jurić100% (1)
- Ako Su Poznati Reaktanti Kemijske Reakcije Mogu Se PredvidjeDocument4 pagesAko Su Poznati Reaktanti Kemijske Reakcije Mogu Se PredvidjeLea MuzekNo ratings yet
- Domaća Zadaća-17. SkupinaDocument4 pagesDomaća Zadaća-17. SkupinaLeopold MacukicNo ratings yet
- Halogeni ElementiDocument3 pagesHalogeni ElementiIvan SkorupanNo ratings yet
- 1.elementi Na Koje NeDocument8 pages1.elementi Na Koje Neazur0301No ratings yet
- Spojevi Halogenih ElemenataDocument3 pagesSpojevi Halogenih ElemenataVolim ČokoladuNo ratings yet
- Halogeni ElementiDocument14 pagesHalogeni ElementiNaidaNo ratings yet
- Halkogeni Elementi - Skripta, 4. Razred Srednje ŠkoleDocument5 pagesHalkogeni Elementi - Skripta, 4. Razred Srednje ŠkolePaolaNo ratings yet
- VodikDocument2 pagesVodikVolim ČokoladuNo ratings yet
- KEMIJSKE PROMJENE I SVOJSTVA TVARI-za TeamsDocument9 pagesKEMIJSKE PROMJENE I SVOJSTVA TVARI-za TeamsWin GamerNo ratings yet
- HCL (G) + H2O (L) H3O+ (Aq) + CL - (Aq) : CH Cooh (Aq) +H2O (L) CH Coo - (Aq) +H O+ (Aq) Ch3Cooh (Aq) CH Coo + HDocument3 pagesHCL (G) + H2O (L) H3O+ (Aq) + CL - (Aq) : CH Cooh (Aq) +H2O (L) CH Coo - (Aq) +H O+ (Aq) Ch3Cooh (Aq) CH Coo + HLucija CrljenkoNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2014 LjetoDocument23 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2014 LjetoIvana05No ratings yet
- VodikDocument4 pagesVodikNina Stanic100% (1)
- Halogeni Elemeti PonavljanjeDocument19 pagesHalogeni Elemeti PonavljanjeTamara Tkalec-CarNo ratings yet
- Plemeniti PlinoviDocument54 pagesPlemeniti PlinoviStjepan Mađaroš100% (1)
- 2.4. Kemijska Svojstva Alkana I HalogenoalkanaDocument17 pages2.4. Kemijska Svojstva Alkana I HalogenoalkanaNikolina CibaricNo ratings yet
- I Analitička Grupa KatjonaDocument10 pagesI Analitička Grupa KatjonaBojana PotparićNo ratings yet
- I Analitička Grupa KatjonaDocument10 pagesI Analitička Grupa KatjonaBojana PotparićNo ratings yet
- Alkalijski I Zemnoalkalijski MetaliDocument3 pagesAlkalijski I Zemnoalkalijski MetaliMarijana ArbunićNo ratings yet
- Brom, Jod, Važniji Spojevi Halogenih ElemenataDocument11 pagesBrom, Jod, Važniji Spojevi Halogenih ElemenataMario IlićNo ratings yet
- 18 Grupa PseDocument4 pages18 Grupa PseAmna SpahićNo ratings yet
- Alkalijski Zemnoalk MetaliDocument18 pagesAlkalijski Zemnoalk MetaliMartina BrkljačaNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 LjetoDocument27 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 Ljetolana.nofaceNo ratings yet
- Spojevi Sa Kisikom I Derivati 01Document83 pagesSpojevi Sa Kisikom I Derivati 01Tomislav CvrtnjakNo ratings yet
- HALKOGENI ELEMENTI - BezDocument27 pagesHALKOGENI ELEMENTI - BezTamara Tkalec-CarNo ratings yet
- 10 - Kiseline I BazeDocument19 pages10 - Kiseline I BazeGusic SalkoNo ratings yet
- Dušikova Skupina ElemenataDocument6 pagesDušikova Skupina ElemenataKatarina BrboraNo ratings yet
- Halkogeni ElementiDocument7 pagesHalkogeni ElementiZvezda NasilnicaNo ratings yet
- ZivaDocument5 pagesZivaRiki BebiNo ratings yet
- Kemijska Svojstva AlkanaDocument10 pagesKemijska Svojstva AlkanaMery LilićNo ratings yet
- Novo Organska Kemija PonavljanjeDocument81 pagesNovo Organska Kemija Ponavljanjestoja.marin12No ratings yet
- Aldehidi I KetoniDocument2 pagesAldehidi I KetoniZanki KatarinaNo ratings yet
- Vjezba 3Document14 pagesVjezba 3emanuelNo ratings yet
- Halogeni Elementi-Grupni RadDocument20 pagesHalogeni Elementi-Grupni RadmarioNo ratings yet
- Elektroliza1 FRDocument11 pagesElektroliza1 FRpasitokogasitopitoNo ratings yet
- Halogenirani UgljikovodiciDocument6 pagesHalogenirani UgljikovodiciksivankaNo ratings yet
- Alkalni MetaliDocument22 pagesAlkalni MetalibelmaNo ratings yet
- Alkalni MetaliDocument34 pagesAlkalni MetaliAmila Ljubovic100% (1)
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008Document24 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008marija kusturaNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2013 JesenDocument24 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2013 JesenIvana05100% (1)
- HALOGENALKANIDocument40 pagesHALOGENALKANIMery LilićNo ratings yet
- 2 Metali PDFDocument67 pages2 Metali PDFMaria LyonsNo ratings yet
- Tehnički Važni MetaliDocument6 pagesTehnički Važni MetaliKarlo Vrančić100% (1)
- Oksidacijski Broj I TDDocument17 pagesOksidacijski Broj I TDAidaTravančićNo ratings yet
- DušikDocument5 pagesDušikZorica ManojlovicNo ratings yet
- Periodičnost Kemijskih Svojstava ElemenataDocument24 pagesPeriodičnost Kemijskih Svojstava ElemenataJust FortniteNo ratings yet
- 1 Aldehidi I Ketoni PDFDocument36 pages1 Aldehidi I Ketoni PDFAnonymous FVvteEHiDONo ratings yet
- 2.3 KloridiDocument12 pages2.3 KloridiMarija PiškorNo ratings yet
- Kemijski Udzbenik SoliDocument24 pagesKemijski Udzbenik Solibotoks uwuNo ratings yet
- VODIKDocument2 pagesVODIKDomagoj PokrovacNo ratings yet
- Kemijske Promjene 2024Document5 pagesKemijske Promjene 2024Martin VidovicNo ratings yet
- KEM4 - RL - Kemijska Analiza Organskih SpojevaDocument6 pagesKEM4 - RL - Kemijska Analiza Organskih SpojevaHana HorvatNo ratings yet
- P3-Aldehidi I KetoniDocument79 pagesP3-Aldehidi I KetoniVladimir StankovićNo ratings yet
- Ugljikova Skupina ElemenataDocument2 pagesUgljikova Skupina ElemenatakekemanxNo ratings yet
- VodikDocument2 pagesVodikVolim ČokoladuNo ratings yet
- Tehnički Važni MetaliDocument2 pagesTehnički Važni MetaliVolim ČokoladuNo ratings yet
- Spojevi Halogenih ElemenataDocument3 pagesSpojevi Halogenih ElemenataVolim ČokoladuNo ratings yet
- Standardni Elektrodni PotencijalDocument2 pagesStandardni Elektrodni PotencijalVolim ČokoladuNo ratings yet
- Viskoznost, Napetost Površine I Miješanje TekućinaDocument5 pagesViskoznost, Napetost Površine I Miješanje TekućinaVolim ČokoladuNo ratings yet
- Vrste Kemijskih VezaDocument3 pagesVrste Kemijskih VezaVolim Čokoladu100% (1)
- Vrste Entalpijskih Reakcija I Hessov ZakonDocument12 pagesVrste Entalpijskih Reakcija I Hessov ZakonVolim Čokoladu100% (1)
- 2010 09 Jdbe Kem Reak RedoxiDocument6 pages2010 09 Jdbe Kem Reak RedoxiVolim ČokoladuNo ratings yet