Professional Documents
Culture Documents
- بطاقة التلميذ رقم 01
- بطاقة التلميذ رقم 01
Uploaded by
Khadidja PhysiqueOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
- بطاقة التلميذ رقم 01
- بطاقة التلميذ رقم 01
Uploaded by
Khadidja PhysiqueCopyright:
Available Formats
السنة ثالثة ثانوي ( ع ت – تقر – ريا ) األستاذ :قسوس براهيم ثانوية بن جامعة محمد
المعايرة ال𝐇𝐩 مترية بطاقة التلميذ رقم 01
مفهوم المعايرة:
تهدف معايرة نوع كيميائي في محلول إلى تعيين تركيزه المولي .يتم تحقيق المعايرة ،عندما نقوم بمفاعلة هذا النوع
الكيميائي ،الذي نسميه المتفاعل ال ُمعَايَر ،مع نوع كيميائي آخر نسميه ال ُمعَا ِير والذي يكون تركيزه المولي معلوم.
الوسائل البيداغوجية المستعملة:
محلول هيدروكسيد الصوديوم (الصودا) )𝑞𝑎() (𝑁𝑎+ + 𝑂𝐻−تركيزه المولي 𝐿 ، 𝐶𝑏 = 0.02 𝑚𝑜𝑙/قارورة بالستيكية
تحتوي على حمض الخل )𝑞𝑎()𝐻𝑂𝑂𝐶 (𝐶𝐻3مجهول التركيز ،ماصة عيارية 𝐿𝑚 ، 10إجاصة ،كؤوس بيشر ،سحاحة
مدرجة ,جهاز الـ𝐻𝑝 متر ,مخالط مغناطيسي.
خطوات العمل :
النشاط التجريبي :معايرة حمض ضعيف بأساس قوي
نضع في البيشر حجما 𝑙𝑚 𝑉𝑎 = 20من حمض اإليثانويك
تركيزه المولي 𝑎𝐶 و نغمر مسبار الـ𝐻𝑝 متر في المحلول.
ثم نمأل السحاحة المدرجة حتى التدريجة الصفر بمحلول
هيدروكسيد الصوديوم ذي التركيز المولي 𝑙𝐶𝑏 = 0.02 𝑚𝑜𝑙/
نسكب تدريجيا المحلول األساسي في البيشر مع الرج المستمر
بواسطة المخالط المغناطيسي لتجانس المحلولين ( الشكل ) 01
نسجل قيمة الـ𝐻𝑝 للمحلول في البيشر بعد كل إضافة للحجم 𝑏𝑉 .
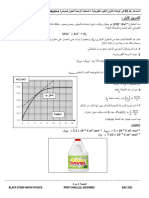
ثم نرسم بعد ذلك منحنى المعايرة ) 𝑏𝑉(𝑓 = 𝐻𝑝 الذي يمثل
تغيرات 𝐻𝑝 المزيج بداللة الحجم المضاف 𝑏𝑉 من المحلول األساسي ( الشكل .) 01
العمل المطلوب:
-1أكتب معادلة تفاعل المعايرة .
-2اشرح كيف يتغير 𝐻𝑝 المحلول في البيشر أثناء المعايرة .
-3حدد بيانيا احداثيي نقطة التكافؤ ) 𝑒𝐻𝑝 ( (𝑉𝑏𝑒𝑞 ,نقطة االنعطاف ) بواسطة المماسين المتوازيين ثم استنتج قيمة
التركيز المولي 𝑎𝐶 للحمض ال ُمعَايَر .
-4ماهو الكاشف المناسب لهذه المعايرة .
𝑞𝑒𝑏𝑉
-5حدد على البيان إحداثيي نقطة نصف التكافؤ ) 𝐻𝑝 ، ( 2 ,ثم استنتج قيمة ال𝑎𝐾𝑝 للثنائية
) )𝑞𝑎(. (𝐶𝐻3 𝐶𝑂𝑂𝐻(𝑎𝑞) / 𝐶𝐻3 𝐶𝑂𝑂−
-6أحسب ثابت التوازن لتفاعل المعايرة ( عند الدرجة ℃ ، ) 25ماذا تستنتج ؟
الشكل 01
1
You might also like
- بطاقة التلميذ رقم 08Document2 pagesبطاقة التلميذ رقم 08zaki48No ratings yet
- Titrages Acido-BasiquesDocument1 pageTitrages Acido-BasiquesOmar KhalfiNo ratings yet
- تعيين كمية المادة بواسطة المعايرة ش.رDocument12 pagesتعيين كمية المادة بواسطة المعايرة ش.رilyesmsegeumNo ratings yet
- Almaairat Almbashra Tmarin Ghir Mhlola 1Document2 pagesAlmaairat Almbashra Tmarin Ghir Mhlola 1yassinselbi021No ratings yet
- تمارين الأحماض و الأسسDocument1 pageتمارين الأحماض و الأسسmouad drouicheNo ratings yet
- وثيقة المعايرة الـpH-متريّة (فارغة)Document2 pagesوثيقة المعايرة الـpH-متريّة (فارغة)emmmy1792No ratings yet
- Almaairat Almbashra Tmarin Ghir Mhlola 1 4Document2 pagesAlmaairat Almbashra Tmarin Ghir Mhlola 1 4Mohammed SmadiNo ratings yet
- المعايرة الحمضية القاعديةDocument4 pagesالمعايرة الحمضية القاعديةالغزيزال الحسن EL GHZIZAL Hassane100% (13)
- Physics 2se22 2trim7Document2 pagesPhysics 2se22 2trim7Youcef JousephNo ratings yet
- Physics 2mtm22 2trim5Document6 pagesPhysics 2mtm22 2trim5mohamed benmouloudNo ratings yet
- وحدة444444Document1 pageوحدة444444Houssem HassouNo ratings yet
- Physics 2se22 2trim7Document2 pagesPhysics 2se22 2trim7BOUCHEFFA HalimNo ratings yet
- BBL 22Document12 pagesBBL 22al maktabaNo ratings yet
- الاختبار الاول ثانوية بونور 2021-2022Document1 pageالاختبار الاول ثانوية بونور 2021-2022Daya Lebaili100% (1)
- تمارين المعايرات المباشرة أولى باك النموذج 1 PDFDocument12 pagesتمارين المعايرات المباشرة أولى باك النموذج 1 PDFAyoub FatheNo ratings yet
- Exc8 1bac PDFDocument3 pagesExc8 1bac PDFMeriem ZAGRIRINo ratings yet
- Physics 2se20 2trim1Document4 pagesPhysics 2se20 2trim1noureddine SILININo ratings yet
- 12 2019 01 25!12 05 43 AmDocument17 pages12 2019 01 25!12 05 43 AmbasheeralajolNo ratings yet
- تمارين مع الحل المفصل حول الأسترة للاستاذ الفاضل بلياسين عبد الجليل1653418652Document27 pagesتمارين مع الحل المفصل حول الأسترة للاستاذ الفاضل بلياسين عبد الجليل1653418652Amrouche KarimaNo ratings yet
- المعايرة المباشرة Le dosage directDocument1 pageالمعايرة المباشرة Le dosage directYassine BerchilNo ratings yet
- الموضوع الخامسDocument2 pagesالموضوع الخامسسمير دبيليNo ratings yet
- Sujet 5 Prof DEBILI SDocument2 pagesSujet 5 Prof DEBILI Sسمير دبيليNo ratings yet
- تمرين جملة كيميائية 3Document1 pageتمرين جملة كيميائية 3zaki48No ratings yet
- units PHYSICS REVISION 3AS ZDN سلسلة التمارين 02Document2 pagesunits PHYSICS REVISION 3AS ZDN سلسلة التمارين 02Melki AmeurNo ratings yet
- الدرس 06Document2 pagesالدرس 06ayoub meradiNo ratings yet
- سلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيDocument10 pagesسلسلة تمارين بالحلولالمعايرة جزء01 كريم سنيTarakk KaziNo ratings yet
- Ex Regul AsservDocument4 pagesEx Regul AsservZahk LbatlNo ratings yet
- وثيقة الأستاذDocument2 pagesوثيقة الأستاذIkram KimiNo ratings yet
- دورة-المراجعة-النهائية_حصة01Document7 pagesدورة-المراجعة-النهائية_حصة01dzphysique48No ratings yet
- Pubdoc 10 20734 1405Document3 pagesPubdoc 10 20734 1405محمد العراقيNo ratings yet
- موضوع بكالوريا 2024Document8 pagesموضوع بكالوريا 2024mustapha7638No ratings yet
- معايرة حمض أساس TP3Document1 pageمعايرة حمض أساس TP3benyamina imaneNo ratings yet
- وحدة 4 سلسلة نهائيةDocument2 pagesوحدة 4 سلسلة نهائيةHassouNo ratings yet
- ملف مساعدة بلغيثDocument8 pagesملف مساعدة بلغيثnadja7.nadja7No ratings yet
- الكيمياء 1920 4 التحليل الكيميائي الالي العملي PDFDocument40 pagesالكيمياء 1920 4 التحليل الكيميائي الالي العملي PDFDr-Haider A. Faraj100% (1)
- تمارين الأحماض و الأسس 2016 2017Document3 pagesتمارين الأحماض و الأسس 2016 2017khalil75No ratings yet
- التتبع الزمني لتحول كيميائي - سرعة التفاعل-الأنشطة1Document4 pagesالتتبع الزمني لتحول كيميائي - سرعة التفاعل-الأنشطة1Mostafa ELJETTINo ratings yet
- سلسلة الوحدة 1 المتابعة الزمنيةDocument8 pagesسلسلة الوحدة 1 المتابعة الزمنيةMohamed Anis LounisNo ratings yet
- التحولات الكيميائية التي تحدث في المنحيينDocument3 pagesالتحولات الكيميائية التي تحدث في المنحيينOmar ait taleb aliNo ratings yet
- المعايرة اللونية-1Document2 pagesالمعايرة اللونية-1h.boukhelfrosasNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2Document9 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2ilyass kannaniNo ratings yet
- تمارين وحلول في الكيمياءDocument3 pagesتمارين وحلول في الكيمياءالغزيزال الحسن EL GHZIZAL Hassane88% (17)
- السلسلة رقم 02 في الوحدة الأولىDocument4 pagesالسلسلة رقم 02 في الوحدة الأولىzineeddine0750No ratings yet
- 2as Serie 07Document20 pages2as Serie 07selma selmaNo ratings yet
- Serie2as - U7 - Acidebase - 2023Document4 pagesSerie2as - U7 - Acidebase - 2023linakhoubzi07No ratings yet
- 2as Serie 07Document20 pages2as Serie 07Ninou ZinouNo ratings yet
- تمارين المعايرة الحمضية القاعديةDocument4 pagesتمارين المعايرة الحمضية القاعديةAzul AzulNo ratings yet
- الدرس 02Document5 pagesالدرس 02Miko ÅıNo ratings yet
- سلسلة مراجعة مكتسبات القبلية الجديدةDocument4 pagesسلسلة مراجعة مكتسبات القبلية الجديدةAbderrahmane henniNo ratings yet
- طرق التحليل الحجميDocument4 pagesطرق التحليل الحجميAhmed Khotcho100% (1)
- Ahmad OusoussDocument6 pagesAhmad Ousoussryad aouidatNo ratings yet
- تمرين 1-3Document2 pagesتمرين 1-3Hani StarkNo ratings yet
- المقرونة تمارينDocument8 pagesالمقرونة تمارينayoubberramram5No ratings yet
- Exercices PC 2bac 0013Document8 pagesExercices PC 2bac 0013aharrar jamilaNo ratings yet
- مفهوم التقدم لتفاعل كيميائي وحصيلة المادةDocument5 pagesمفهوم التقدم لتفاعل كيميائي وحصيلة المادةAICHA MERABETNo ratings yet
- Compo215MTer ArbaouiDocument4 pagesCompo215MTer ArbaouiNabilKarmNo ratings yet
- التحولات ح,ق و الكهرباءDocument1 pageالتحولات ح,ق و الكهرباءYassine0% (1)