Professional Documents
Culture Documents
Phu Luc
Phu Luc
Uploaded by
Dang Chi CongCopyright:
Available Formats
You might also like
- Thong Tu So 032019tt - 1556270387Document21 pagesThong Tu So 032019tt - 1556270387Ha NguyenNo ratings yet
- Handout Dai Cuong Bao CheDocument11 pagesHandout Dai Cuong Bao CheNguyễn Văn Ý.No ratings yet
- SACH THUC TAP PHÁP CHẾ DƯỢC - 1Document45 pagesSACH THUC TAP PHÁP CHẾ DƯỢC - 1HoaNo ratings yet
- Danh Muc Thuoc Thiet YeuDocument43 pagesDanh Muc Thuoc Thiet Yeuletrongnam69No ratings yet
- GSP&GDP (Handouts)Document113 pagesGSP&GDP (Handouts)Trịnh Hoàng TríNo ratings yet
- Huong Dan On Tap Thong Tin Va Tu Van SDT-K74Document5 pagesHuong Dan On Tap Thong Tin Va Tu Van SDT-K74Nguyễn Huy HoàngNo ratings yet
- Thong Tu 03-2019-TT-ByT Danh Muc Thuoc San Xuat Trong Nuoc Dap Ung Yeu Cau Ve Dieu Tri, Gia Thuoc Va Kha Nang Cung CapDocument42 pagesThong Tu 03-2019-TT-ByT Danh Muc Thuoc San Xuat Trong Nuoc Dap Ung Yeu Cau Ve Dieu Tri, Gia Thuoc Va Kha Nang Cung CapNhan HoNo ratings yet
- Phụ LụcDocument12 pagesPhụ LụcGiang Kieu HoangNo ratings yet
- R&D Pharma LabsDocument19 pagesR&D Pharma Labsthanh luan vuNo ratings yet
- (123doc) Quan Ly Thuoc Gay Nghien Huong Tam Than Tien ChatDocument84 pages(123doc) Quan Ly Thuoc Gay Nghien Huong Tam Than Tien Chatvan deNo ratings yet
- Pháp Chế DượcDocument11 pagesPháp Chế DượcThảo PhươngNo ratings yet
- Bài 2. Danh Pháp Và Phân Loại ThuốcDocument105 pagesBài 2. Danh Pháp Và Phân Loại ThuốcĐạt Nguyễn ThànhNo ratings yet
- 21DDUA1 Nhom 08Document28 pages21DDUA1 Nhom 08cong3578951No ratings yet
- 2016 - Bang Gia Thuoc Va Vtyt - 2Document17 pages2016 - Bang Gia Thuoc Va Vtyt - 2Hong Ngoc HoNo ratings yet
- Quy chuẩn kỹ thuật quốc gia QCVN 01- 042009BNNPTNT Kỹ thuật lấy và bảo quản mẫu thịt tươi từ các cơ sở giết mổ và kinh doanh thịt để kiểm tra vi siDocument39 pagesQuy chuẩn kỹ thuật quốc gia QCVN 01- 042009BNNPTNT Kỹ thuật lấy và bảo quản mẫu thịt tươi từ các cơ sở giết mổ và kinh doanh thịt để kiểm tra vi siĐào Ngô Tú QuỳnhNo ratings yet
- quy trình sản xuất thuốc gerenicDocument7 pagesquy trình sản xuất thuốc gerenicTrần Như QuỳnhNo ratings yet
- danh mục thuốc trong nước đáp ứng điều trị 2016Document6 pagesdanh mục thuốc trong nước đáp ứng điều trị 2016Dang Chi CongNo ratings yet
- T 3 CA Sáng 510 Linh Lâm 255Document17 pagesT 3 CA Sáng 510 Linh Lâm 255hoanghlinh08102004No ratings yet
- Báo Cáo Kết Quả Tham Quan Tại Nhà ThuốcDocument16 pagesBáo Cáo Kết Quả Tham Quan Tại Nhà Thuốchoanghlinh08102004No ratings yet
- Phu Luc 5. Chu Truong Chung Trong DKTDocument4 pagesPhu Luc 5. Chu Truong Chung Trong DKTNhung MaiNo ratings yet
- BCTN1Document40 pagesBCTN1cinshin0403No ratings yet
- Thuốc Giống Nhau, Gần Giống NhauDocument6 pagesThuốc Giống Nhau, Gần Giống Nhaunani officalNo ratings yet
- 19-11A9-Hoàng Thu Trang-BCTN1Document32 pages19-11A9-Hoàng Thu Trang-BCTN1cinshin0403No ratings yet
- 664 QĐ QLDDocument34 pages664 QĐ QLDTrần Mạnh HoàngNo ratings yet
- GT Kiem - NghiemDocument192 pagesGT Kiem - NghiemduonghandiepNo ratings yet
- Lý Thuyết Kiểm NghiệmDocument98 pagesLý Thuyết Kiểm Nghiệmanhngoc20012002No ratings yet
- Phu Luc 6-11-20 - Sua 3011Document28 pagesPhu Luc 6-11-20 - Sua 3011TUYET MAINo ratings yet
- Tong Hop KKL Thuoc NK Tinh Den Ngay.24.7.2014Document120 pagesTong Hop KKL Thuoc NK Tinh Den Ngay.24.7.2014Thành Trung NguyễnNo ratings yet
- Danh Muc Thuoc Lao 159Document4 pagesDanh Muc Thuoc Lao 159nguyenhuutinh396No ratings yet
- Danh Muc Thuoc Thiet YeuDocument2 pagesDanh Muc Thuoc Thiet Yeusharemcsa100% (1)
- Chăm Sóc Dư CDocument46 pagesChăm Sóc Dư CLam Thuan DoNo ratings yet
- ĐHHNDDocument152 pagesĐHHNDLam Thuan DoNo ratings yet
- Báo Cáo Thực Tập Khoa Dược Bệnh Viện Đa Khoa Tiên LữDocument28 pagesBáo Cáo Thực Tập Khoa Dược Bệnh Viện Đa Khoa Tiên LữNgọc TânNo ratings yet
- Nhóm 2 D4A Marketing Mix GSKDocument48 pagesNhóm 2 D4A Marketing Mix GSKNgan ThaoNo ratings yet
- Báo Cáo TT LC 4Document23 pagesBáo Cáo TT LC 4Cuteen NhokNo ratings yet
- Thong Tu 15Document56 pagesThong Tu 15Thanh PhamNo ratings yet
- AmoxDocument11 pagesAmoxjpwgcp2c4yNo ratings yet
- Cộng Hòa Xã Hội Chủ Nghĩa Việt Nam Cục Quản Lý DượcDocument10 pagesCộng Hòa Xã Hội Chủ Nghĩa Việt Nam Cục Quản Lý DượcXuan Nhi NguyenNo ratings yet
- 19 2018 TT Byt 2018Document75 pages19 2018 TT Byt 2018Khoa ĐinhNo ratings yet
- Lyphochek Assayed Chemistry Control Levels 1 and 2: Trang 1 - 2020-02 - 4030-00 /Vietnamese Tiếng ViệtDocument4 pagesLyphochek Assayed Chemistry Control Levels 1 and 2: Trang 1 - 2020-02 - 4030-00 /Vietnamese Tiếng ViệtLabnotes LCNo ratings yet
- Hướng Dẫn Phân Loại - Sắp Xếp - Trưng Bày Trong Kho Gsp Hoặc Nhà Thuốc GppDocument4 pagesHướng Dẫn Phân Loại - Sắp Xếp - Trưng Bày Trong Kho Gsp Hoặc Nhà Thuốc GppĐạt Nguyễn ThànhNo ratings yet
- Bạch Văn Dương - Bài Giảng Điều Dưỡng - Pha Chế Thuốc Điều Trị Ung Thư Tại Khoa Lâm SàngDocument64 pagesBạch Văn Dương - Bài Giảng Điều Dưỡng - Pha Chế Thuốc Điều Trị Ung Thư Tại Khoa Lâm SàngHoa MiNo ratings yet
- Công nghệ sản xuất viên nénDocument76 pagesCông nghệ sản xuất viên nénvytruong8a1hongbangNo ratings yet
- GMPDocument174 pagesGMPluckyfrienddnNo ratings yet
- Biểu mẫu hồ sơ đăng kýDocument7 pagesBiểu mẫu hồ sơ đăng kýHa HuongNo ratings yet
- Đề Cương Kiểm NghiệmDocument22 pagesĐề Cương Kiểm Nghiệmhaitran9999No ratings yet
- Danh Muc Thuoc Benh Vien Dai Hoc y Duoc HueDocument150 pagesDanh Muc Thuoc Benh Vien Dai Hoc y Duoc HueNguyen ThuyNo ratings yet
- Lý thuyết DL 1 - 2605Document1 pageLý thuyết DL 1 - 2605Lê Thảo NguyênNo ratings yet
- Cau Hoi On Thi Ket Thuc Mon DLCB 2022Document7 pagesCau Hoi On Thi Ket Thuc Mon DLCB 2022Khoa PhạmNo ratings yet
- Bài 2 QLDDocument27 pagesBài 2 QLDdtrphuNo ratings yet
- Tong Hop KK Thuoc NK Tinh Den Ngay 24.7.2014Document1,080 pagesTong Hop KK Thuoc NK Tinh Den Ngay 24.7.2014Thành Trung Nguyễn0% (1)
- Phu Luc 5. Chu Truong Chung Trong DKTDocument3 pagesPhu Luc 5. Chu Truong Chung Trong DKT2127 Nguyễn Tiến KiênNo ratings yet
- bài 2 đề 5-6Document17 pagesbài 2 đề 5-6GordanVANNo ratings yet
- Bài IDocument7 pagesBài IThảo Đỗ Tâm ThuNo ratings yet
- thầy Tuấn - Huong dan cua Asean ve nghien cuu do on dinh cua thuoc - 03-04-2018 PDFDocument62 pagesthầy Tuấn - Huong dan cua Asean ve nghien cuu do on dinh cua thuoc - 03-04-2018 PDFNguyễn Xuân ĐạiNo ratings yet
- Nhóm 6.1 A4K77 - Bài 1Document18 pagesNhóm 6.1 A4K77 - Bài 1minhcerryNo ratings yet
- Cap Nhat Mot So Kien Thuc NCKH Moi - SignedDocument9 pagesCap Nhat Mot So Kien Thuc NCKH Moi - SignedDang Chi CongNo ratings yet
- Công bố PICS Đợt 65 - Danh sách Không đạtDocument4 pagesCông bố PICS Đợt 65 - Danh sách Không đạtDang Chi CongNo ratings yet
- danh mục thuốc trong nước đáp ứng điều trị 2016Document6 pagesdanh mục thuốc trong nước đáp ứng điều trị 2016Dang Chi CongNo ratings yet
- danh mục thuốc TDSH 22Document6 pagesdanh mục thuốc TDSH 22Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 1Document9 pagesĐánh Giá Vaccine 1Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 2Document7 pagesĐánh Giá Vaccine 2Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 3Document9 pagesĐánh Giá Vaccine 3Dang Chi CongNo ratings yet
- Bảng Thành Phần Dinh DưỡngDocument16 pagesBảng Thành Phần Dinh DưỡngDang Chi CongNo ratings yet
- Đánh Giá Vaccine 5Document7 pagesĐánh Giá Vaccine 5Dang Chi CongNo ratings yet
- Không Đ T EUGMP 1Document3 pagesKhông Đ T EUGMP 1Dang Chi CongNo ratings yet
- Không Đ T EUGMPDocument6 pagesKhông Đ T EUGMPDang Chi CongNo ratings yet
- Không Đ T EUGMP 3Document3 pagesKhông Đ T EUGMP 3Dang Chi CongNo ratings yet
- Công Bố PICS Đợt 65 - Danh Sách Giải TrìnhDocument4 pagesCông Bố PICS Đợt 65 - Danh Sách Giải TrìnhDang Chi CongNo ratings yet
Phu Luc
Phu Luc
Uploaded by
Dang Chi CongOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Phu Luc
Phu Luc
Uploaded by
Dang Chi CongCopyright:
Available Formats
PHỤ LỤC 1
NGUYÊN TẮC LỰA CHỌN THUỐC ĐỐI CHỨNG DÙNG TRONG
NGHIÊN CỨU TƯƠNG ĐƯƠNG SINH HỌC PHỤC VỤ ĐĂNG KÝ THUỐC
(Ban hành kèm theo Thông tư số 08/2010/TT-BYT ngày 26/4/2010)
Thuốc đối chứng dùng trong các nghiên cứu tương đương sinh học phục vụ
đăng ký thuốc được lựa chọn theo thứ tự ưu tiên sau:
1. Thuốc đối chứng là thuốc phát minh với đầy đủ các số liệu về chất lượng,
an toàn và hiệu quả, đã được cấp phép và đang được lưu hành tại Việt Nam.
2. Thuốc đối chứng thuộc Danh sách thuốc đối chứng của Tổ chức Y tế Thế
giới (WHO comparator list), là những thuốc đã được cấp phép lưu hành căn cứ vào
các số liệu về chất lượng, an toàn và hiệu quả của thuốc. Các thông tin về nhà sản
xuất và nước sản xuất đầu tiên của thuốc được cung cấp kèm theo trong Danh mục.
Thuốc đối chứng sử dụng trong nghiên cứu phải được mua tại nước sản xuất đầu
tiên này.
3. Thuốc đối chứng là thuốc phát minh đã được cấp phép và đang được lưu
hành tại một trong các nước thành viên của Hội nghị hoà hợp quốc tế (ICH- gồm
các nước thuộc EU, Mỹ, Nhật Bản) hoặc tại Canada, Úc, Thụy Sỹ. Thuốc đối
chứng sử dụng trong nghiên cứu phải được mua tại một trong các nước nơi thuốc
được cấp phép lưu hành trên.
4. Trong trường hợp không xác định được thuốc phát minh, tiêu chuẩn lựa
chọn thuốc đối chứng được sắp xếp theo thứ tự ưu tiên sau:
a) Thuốc đã được cấp phép và đang được lưu hành tại một trong các nước
thành viên của Hội nghị hoà hợp quốc tế nêu trên hoặc tại Canada, Úc, Thụy Sỹ.
b) Thuốc đã được đánh giá chất lượng (prequalified) bởi Tổ chức Y tế Thế
giới.
Trong cả hai trường hợp trên, thuốc phải đạt các tiêu chuẩn của Dược điển
nếu có tồn tại các tiêu chuẩn này.
PHỤ LỤC 2
DANH MỤC CÁC DƯỢC CHẤT YÊU CẦU BÁO CÁO SỐ LIỆU
NGHIÊN CỨU TƯƠNG ĐƯƠNG SINH HỌC KHI ĐĂNG KÝ THUỐC
(Ban hành lần thứ nhất)
(Ban hành kèm theo Thông tư số 08/2010/TT-BYT ngày 26/4/2010)
1. Mục đích ban hành danh mục
Bộ Y tế ban hành Danh mục các dược chất yêu cầu báo cáo số liệu nghiên
cứu tương đương sinh học khi đăng ký thuốc nhằm từng bước nâng cao chất lượng
thuốc generic lưu hành trên thị trường và đáp ứng các yêu cầu về hoà hợp trong
lĩnh vực đăng ký thuốc giữa các nước ASEAN.
Danh mục này được cập nhật hàng năm hoặc khi có các yêu cầu về quản lý
cần phải đáp ứng ngay nhằm đảm bảo tính an toàn và hiệu quả của thuốc được lưu
hành.
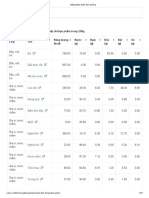
2. Danh mục các dược chất và các thuốc đối chứng tương ứng
STT Tên dược chất Thuốc đối chứng Nhà sản xuất (1)
(Dạng bào chế- Hàm lượng) (Nước sản xuất/ Nước
cấp phép lưu hành)(2)
1 Amlodipin Amlor- Viên nang 5mg. Pfizer PGM (Pháp)
2 Azithromycin Zithromax- Bột pha hỗn dịch Pfizer Italia (Ý)
uống 200mg/5ml
3 Carbamazepin Tegretol- Viên nén 200mg. Novatis Pharma S.p.A (Ý)
4 Cefixim Oroken*- Viên nén bao phim Famar Lyon (Pháp)
200mg; Bột pha hỗn dịch
uống 40mg/ 5ml và 100mg/
5ml ; Cốm pha hỗn dịch uống
40mg và 100mg.
5 Cefuroxim Zinnat- Viên nén bao phim Glaxo Operation UK Ltd.
Axetil 125mg, 500mg (Vương quốc Anh)
6 Clarithromycin Klacid- Viên nén bao phim Abbott Laboratories Ltd.
250mg, 500mg. (Vương quốc Anh)
Klacid- Cốm pha hỗn dịch PT Abbott Indonesia
uống 125mg/5ml. (Indonesia)
7 Glibenclamid Daonil** - Viên nén 5mg Aventis Pharma (Nhật Bản)
8 Gliclazid Diamicron- Viên nén 80mg. Les Laboratoires Servier
Industrie (Pháp)
9 Metformin Glucophage- Viên nén bao Merck Sante s.a.s. (Pháp)
phim 500mg, 850mg,
1000mg.
10 Metoprolol Betaloc- Viên nén 50mg. AstraZeneca (Philipin)
11 Nifedipin Adalat- Viên nang mềm R.P. Scherer GmbH & Co.
10mg. Germany (Đức)
Adalat*- Viên nang mềm Bayer Health Care (Đức)
5mg,
12 Rifampicin Rimactane*- Viên nén 150mg. Novatis (Thụy Sỹ)
* Thuốc phát minh này hiện không lưu hành tại Việt Nam. Thuốc được mua
tại nước sản xuất theo thông tin trong danh mục.
** Thuốc phát minh này hiện không lưu hành tại Việt Nam. Thuốc được mua
tại nước nơi thuốc đã được cấp phép lưu hành theo thông tin trong danh mục.
You might also like
- Thong Tu So 032019tt - 1556270387Document21 pagesThong Tu So 032019tt - 1556270387Ha NguyenNo ratings yet
- Handout Dai Cuong Bao CheDocument11 pagesHandout Dai Cuong Bao CheNguyễn Văn Ý.No ratings yet
- SACH THUC TAP PHÁP CHẾ DƯỢC - 1Document45 pagesSACH THUC TAP PHÁP CHẾ DƯỢC - 1HoaNo ratings yet
- Danh Muc Thuoc Thiet YeuDocument43 pagesDanh Muc Thuoc Thiet Yeuletrongnam69No ratings yet
- GSP&GDP (Handouts)Document113 pagesGSP&GDP (Handouts)Trịnh Hoàng TríNo ratings yet
- Huong Dan On Tap Thong Tin Va Tu Van SDT-K74Document5 pagesHuong Dan On Tap Thong Tin Va Tu Van SDT-K74Nguyễn Huy HoàngNo ratings yet
- Thong Tu 03-2019-TT-ByT Danh Muc Thuoc San Xuat Trong Nuoc Dap Ung Yeu Cau Ve Dieu Tri, Gia Thuoc Va Kha Nang Cung CapDocument42 pagesThong Tu 03-2019-TT-ByT Danh Muc Thuoc San Xuat Trong Nuoc Dap Ung Yeu Cau Ve Dieu Tri, Gia Thuoc Va Kha Nang Cung CapNhan HoNo ratings yet
- Phụ LụcDocument12 pagesPhụ LụcGiang Kieu HoangNo ratings yet
- R&D Pharma LabsDocument19 pagesR&D Pharma Labsthanh luan vuNo ratings yet
- (123doc) Quan Ly Thuoc Gay Nghien Huong Tam Than Tien ChatDocument84 pages(123doc) Quan Ly Thuoc Gay Nghien Huong Tam Than Tien Chatvan deNo ratings yet
- Pháp Chế DượcDocument11 pagesPháp Chế DượcThảo PhươngNo ratings yet
- Bài 2. Danh Pháp Và Phân Loại ThuốcDocument105 pagesBài 2. Danh Pháp Và Phân Loại ThuốcĐạt Nguyễn ThànhNo ratings yet
- 21DDUA1 Nhom 08Document28 pages21DDUA1 Nhom 08cong3578951No ratings yet
- 2016 - Bang Gia Thuoc Va Vtyt - 2Document17 pages2016 - Bang Gia Thuoc Va Vtyt - 2Hong Ngoc HoNo ratings yet
- Quy chuẩn kỹ thuật quốc gia QCVN 01- 042009BNNPTNT Kỹ thuật lấy và bảo quản mẫu thịt tươi từ các cơ sở giết mổ và kinh doanh thịt để kiểm tra vi siDocument39 pagesQuy chuẩn kỹ thuật quốc gia QCVN 01- 042009BNNPTNT Kỹ thuật lấy và bảo quản mẫu thịt tươi từ các cơ sở giết mổ và kinh doanh thịt để kiểm tra vi siĐào Ngô Tú QuỳnhNo ratings yet
- quy trình sản xuất thuốc gerenicDocument7 pagesquy trình sản xuất thuốc gerenicTrần Như QuỳnhNo ratings yet
- danh mục thuốc trong nước đáp ứng điều trị 2016Document6 pagesdanh mục thuốc trong nước đáp ứng điều trị 2016Dang Chi CongNo ratings yet
- T 3 CA Sáng 510 Linh Lâm 255Document17 pagesT 3 CA Sáng 510 Linh Lâm 255hoanghlinh08102004No ratings yet
- Báo Cáo Kết Quả Tham Quan Tại Nhà ThuốcDocument16 pagesBáo Cáo Kết Quả Tham Quan Tại Nhà Thuốchoanghlinh08102004No ratings yet
- Phu Luc 5. Chu Truong Chung Trong DKTDocument4 pagesPhu Luc 5. Chu Truong Chung Trong DKTNhung MaiNo ratings yet
- BCTN1Document40 pagesBCTN1cinshin0403No ratings yet
- Thuốc Giống Nhau, Gần Giống NhauDocument6 pagesThuốc Giống Nhau, Gần Giống Nhaunani officalNo ratings yet
- 19-11A9-Hoàng Thu Trang-BCTN1Document32 pages19-11A9-Hoàng Thu Trang-BCTN1cinshin0403No ratings yet
- 664 QĐ QLDDocument34 pages664 QĐ QLDTrần Mạnh HoàngNo ratings yet
- GT Kiem - NghiemDocument192 pagesGT Kiem - NghiemduonghandiepNo ratings yet
- Lý Thuyết Kiểm NghiệmDocument98 pagesLý Thuyết Kiểm Nghiệmanhngoc20012002No ratings yet
- Phu Luc 6-11-20 - Sua 3011Document28 pagesPhu Luc 6-11-20 - Sua 3011TUYET MAINo ratings yet
- Tong Hop KKL Thuoc NK Tinh Den Ngay.24.7.2014Document120 pagesTong Hop KKL Thuoc NK Tinh Den Ngay.24.7.2014Thành Trung NguyễnNo ratings yet
- Danh Muc Thuoc Lao 159Document4 pagesDanh Muc Thuoc Lao 159nguyenhuutinh396No ratings yet
- Danh Muc Thuoc Thiet YeuDocument2 pagesDanh Muc Thuoc Thiet Yeusharemcsa100% (1)
- Chăm Sóc Dư CDocument46 pagesChăm Sóc Dư CLam Thuan DoNo ratings yet
- ĐHHNDDocument152 pagesĐHHNDLam Thuan DoNo ratings yet
- Báo Cáo Thực Tập Khoa Dược Bệnh Viện Đa Khoa Tiên LữDocument28 pagesBáo Cáo Thực Tập Khoa Dược Bệnh Viện Đa Khoa Tiên LữNgọc TânNo ratings yet
- Nhóm 2 D4A Marketing Mix GSKDocument48 pagesNhóm 2 D4A Marketing Mix GSKNgan ThaoNo ratings yet
- Báo Cáo TT LC 4Document23 pagesBáo Cáo TT LC 4Cuteen NhokNo ratings yet
- Thong Tu 15Document56 pagesThong Tu 15Thanh PhamNo ratings yet
- AmoxDocument11 pagesAmoxjpwgcp2c4yNo ratings yet
- Cộng Hòa Xã Hội Chủ Nghĩa Việt Nam Cục Quản Lý DượcDocument10 pagesCộng Hòa Xã Hội Chủ Nghĩa Việt Nam Cục Quản Lý DượcXuan Nhi NguyenNo ratings yet
- 19 2018 TT Byt 2018Document75 pages19 2018 TT Byt 2018Khoa ĐinhNo ratings yet
- Lyphochek Assayed Chemistry Control Levels 1 and 2: Trang 1 - 2020-02 - 4030-00 /Vietnamese Tiếng ViệtDocument4 pagesLyphochek Assayed Chemistry Control Levels 1 and 2: Trang 1 - 2020-02 - 4030-00 /Vietnamese Tiếng ViệtLabnotes LCNo ratings yet
- Hướng Dẫn Phân Loại - Sắp Xếp - Trưng Bày Trong Kho Gsp Hoặc Nhà Thuốc GppDocument4 pagesHướng Dẫn Phân Loại - Sắp Xếp - Trưng Bày Trong Kho Gsp Hoặc Nhà Thuốc GppĐạt Nguyễn ThànhNo ratings yet
- Bạch Văn Dương - Bài Giảng Điều Dưỡng - Pha Chế Thuốc Điều Trị Ung Thư Tại Khoa Lâm SàngDocument64 pagesBạch Văn Dương - Bài Giảng Điều Dưỡng - Pha Chế Thuốc Điều Trị Ung Thư Tại Khoa Lâm SàngHoa MiNo ratings yet
- Công nghệ sản xuất viên nénDocument76 pagesCông nghệ sản xuất viên nénvytruong8a1hongbangNo ratings yet
- GMPDocument174 pagesGMPluckyfrienddnNo ratings yet
- Biểu mẫu hồ sơ đăng kýDocument7 pagesBiểu mẫu hồ sơ đăng kýHa HuongNo ratings yet
- Đề Cương Kiểm NghiệmDocument22 pagesĐề Cương Kiểm Nghiệmhaitran9999No ratings yet
- Danh Muc Thuoc Benh Vien Dai Hoc y Duoc HueDocument150 pagesDanh Muc Thuoc Benh Vien Dai Hoc y Duoc HueNguyen ThuyNo ratings yet
- Lý thuyết DL 1 - 2605Document1 pageLý thuyết DL 1 - 2605Lê Thảo NguyênNo ratings yet
- Cau Hoi On Thi Ket Thuc Mon DLCB 2022Document7 pagesCau Hoi On Thi Ket Thuc Mon DLCB 2022Khoa PhạmNo ratings yet
- Bài 2 QLDDocument27 pagesBài 2 QLDdtrphuNo ratings yet
- Tong Hop KK Thuoc NK Tinh Den Ngay 24.7.2014Document1,080 pagesTong Hop KK Thuoc NK Tinh Den Ngay 24.7.2014Thành Trung Nguyễn0% (1)
- Phu Luc 5. Chu Truong Chung Trong DKTDocument3 pagesPhu Luc 5. Chu Truong Chung Trong DKT2127 Nguyễn Tiến KiênNo ratings yet
- bài 2 đề 5-6Document17 pagesbài 2 đề 5-6GordanVANNo ratings yet
- Bài IDocument7 pagesBài IThảo Đỗ Tâm ThuNo ratings yet
- thầy Tuấn - Huong dan cua Asean ve nghien cuu do on dinh cua thuoc - 03-04-2018 PDFDocument62 pagesthầy Tuấn - Huong dan cua Asean ve nghien cuu do on dinh cua thuoc - 03-04-2018 PDFNguyễn Xuân ĐạiNo ratings yet
- Nhóm 6.1 A4K77 - Bài 1Document18 pagesNhóm 6.1 A4K77 - Bài 1minhcerryNo ratings yet
- Cap Nhat Mot So Kien Thuc NCKH Moi - SignedDocument9 pagesCap Nhat Mot So Kien Thuc NCKH Moi - SignedDang Chi CongNo ratings yet
- Công bố PICS Đợt 65 - Danh sách Không đạtDocument4 pagesCông bố PICS Đợt 65 - Danh sách Không đạtDang Chi CongNo ratings yet
- danh mục thuốc trong nước đáp ứng điều trị 2016Document6 pagesdanh mục thuốc trong nước đáp ứng điều trị 2016Dang Chi CongNo ratings yet
- danh mục thuốc TDSH 22Document6 pagesdanh mục thuốc TDSH 22Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 1Document9 pagesĐánh Giá Vaccine 1Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 2Document7 pagesĐánh Giá Vaccine 2Dang Chi CongNo ratings yet
- Đánh Giá Vaccine 3Document9 pagesĐánh Giá Vaccine 3Dang Chi CongNo ratings yet
- Bảng Thành Phần Dinh DưỡngDocument16 pagesBảng Thành Phần Dinh DưỡngDang Chi CongNo ratings yet
- Đánh Giá Vaccine 5Document7 pagesĐánh Giá Vaccine 5Dang Chi CongNo ratings yet
- Không Đ T EUGMP 1Document3 pagesKhông Đ T EUGMP 1Dang Chi CongNo ratings yet
- Không Đ T EUGMPDocument6 pagesKhông Đ T EUGMPDang Chi CongNo ratings yet
- Không Đ T EUGMP 3Document3 pagesKhông Đ T EUGMP 3Dang Chi CongNo ratings yet
- Công Bố PICS Đợt 65 - Danh Sách Giải TrìnhDocument4 pagesCông Bố PICS Đợt 65 - Danh Sách Giải TrìnhDang Chi CongNo ratings yet