Professional Documents
Culture Documents
Kwasy Karboksylowe - Budowa I Właściwości
Kwasy Karboksylowe - Budowa I Właściwości
Uploaded by
Agnieszka MurawskaCopyright:
Available Formats
You might also like
- Kwasy Karboksylowe - Otrzymywania I ReakcjeDocument5 pagesKwasy Karboksylowe - Otrzymywania I ReakcjeAgnieszka MurawskaNo ratings yet
- Kwasy Karboksylowe - Otrzymywania I ReakcjeDocument5 pagesKwasy Karboksylowe - Otrzymywania I ReakcjeAgnieszka MurawskaNo ratings yet
- 07 - Reakcje W Roztworach WodnychDocument20 pages07 - Reakcje W Roztworach WodnychWiktoria ZachejaNo ratings yet
- Wlasciwosci Fizyczne Zwiazkow Zawierajacych Grupe KarboksylowaDocument27 pagesWlasciwosci Fizyczne Zwiazkow Zawierajacych Grupe KarboksylowaPatrycja ŁotockaNo ratings yet
- Chemia Moc Kwasów OrganicznychDocument5 pagesChemia Moc Kwasów OrganicznychJanina LasNo ratings yet
- Chemia Organiczna - Systematyka Związków Organicznych.Document56 pagesChemia Organiczna - Systematyka Związków Organicznych.wæraNo ratings yet
- Kwasy Karboksylowe - BudowaDocument16 pagesKwasy Karboksylowe - BudowaPoczciwy CypekNo ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinymalenka87No ratings yet
- Chemia NotatkiDocument2 pagesChemia Notatkirafalcisowski842No ratings yet
- Alkany ZuziaDocument17 pagesAlkany ZuziaPiotrek WalczakNo ratings yet
- Wyklad OrganikaDocument80 pagesWyklad Organikamarcelw11No ratings yet
- Weglowodory - PrezentacjaDocument32 pagesWeglowodory - PrezentacjaMarcin MajNo ratings yet
- Chemia Organiczna DefinicjeDocument2 pagesChemia Organiczna DefinicjeGabi PlNo ratings yet
- ZW KarbonDocument46 pagesZW KarbonJan KowalskiNo ratings yet
- Zrzut Ekranu 2024-03-17 o 22.31.03Document186 pagesZrzut Ekranu 2024-03-17 o 22.31.03adamczewskadariaNo ratings yet
- Na Jakie Grupy Dzieli Sie WeglowodoryDocument23 pagesNa Jakie Grupy Dzieli Sie WeglowodoryxpaulisNo ratings yet
- Reakcje Chemicznew Roztworach WodnychDocument14 pagesReakcje Chemicznew Roztworach WodnychJanek LazurNo ratings yet
- Opracowanie 2018Document17 pagesOpracowanie 2018Kuba OlszewskiNo ratings yet
- WDWWDocument34 pagesWDWWMa CieNo ratings yet
- Chemia, Węglowodory, AlkanyDocument3 pagesChemia, Węglowodory, AlkanyDominika CzortekNo ratings yet
- Zaliczenie Z Chemii TechnicznejDocument4 pagesZaliczenie Z Chemii Technicznejolek.siedleckiNo ratings yet
- ChempDocument9 pagesChemppilak.pilak1234No ratings yet
- Szereg Homologiczny Kwasów KarboksylowychDocument2 pagesSzereg Homologiczny Kwasów KarboksylowychAdamNo ratings yet
- Jakie Czynniki Wplywaja Na Reaktywnosc I Moc Kwasow KarboksylowychDocument37 pagesJakie Czynniki Wplywaja Na Reaktywnosc I Moc Kwasow Karboksylowychola112248No ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinyagnik56No ratings yet
- Badanie Wlasciwosci Redukujacych Kwasu Mrowkowego MetanowegoDocument29 pagesBadanie Wlasciwosci Redukujacych Kwasu Mrowkowego MetanowegoEmiliaNo ratings yet
- Weglowodory o Wielokrotnych Wiazaniach Miedzy Atomami Wegla 2Document29 pagesWeglowodory o Wielokrotnych Wiazaniach Miedzy Atomami Wegla 2Влада БережковNo ratings yet
- Notatki Preparatyka WG ZagadnienDocument54 pagesNotatki Preparatyka WG ZagadnienHizuNo ratings yet
- Węglowodany NasyconeDocument5 pagesWęglowodany Nasyconejulita17No ratings yet
- Alkany, Alkiny, AlkenyDocument2 pagesAlkany, Alkiny, AlkenybanucholaNo ratings yet
- Dysocjacja Elektrolityczna KwasówDocument12 pagesDysocjacja Elektrolityczna Kwasówvanessa.poeckh13No ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinyiwonkasia100% (5)
- 6 4-NoteDocument3 pages6 4-Notewikaa aaNo ratings yet
- Chemia Klasa 8 Temat Podsumowanie - Pochodne WęglowodorówDocument8 pagesChemia Klasa 8 Temat Podsumowanie - Pochodne WęglowodorówfavortojaNo ratings yet
- Akwa - Amina - I HydroksokompleksyDocument18 pagesAkwa - Amina - I HydroksokompleksyWiktoria Frania NowakNo ratings yet
- Badanie Wlasciwosci RedukujacychDocument24 pagesBadanie Wlasciwosci RedukujacychDiesel PowerNo ratings yet
- Alkohole Kwasy Karboksylowe Estry Aminy Aminokwasy SprawdzianDocument2 pagesAlkohole Kwasy Karboksylowe Estry Aminy Aminokwasy SprawdzianPAN PAWEŁ0% (4)
- Reaktywność ArenówDocument23 pagesReaktywność ArenówErica MyersNo ratings yet
- Porownywanie Mocy Kwasow Karboksylowych I NieorganicznychDocument27 pagesPorownywanie Mocy Kwasow Karboksylowych I NieorganicznychJulia SakowiczNo ratings yet
- Kwasy KarboksyloweDocument11 pagesKwasy KarboksylowehankuczerwNo ratings yet
- KwasyDocument3 pagesKwasysukinsynNo ratings yet
- Chemia Ładunkowa ćw1Document3 pagesChemia Ładunkowa ćw1Łukasz JońskiNo ratings yet
- Sulfonowanie BenzenuDocument17 pagesSulfonowanie BenzenuOla MachowskaNo ratings yet
- W Jaki Sposob Zapisuje Sie Wzory Soli Kwasow KarboksylowychDocument16 pagesW Jaki Sposob Zapisuje Sie Wzory Soli Kwasow Karboksylowychpatrycja.chmuraaNo ratings yet
- 2dysocjacja ElektrolitycznaDocument4 pages2dysocjacja ElektrolitycznaNatalia WojewódkaNo ratings yet
- CH CH + H CH - CH CH CH + 2 H CH - CH: Właściwości Fizyczne AlkanówDocument1 pageCH CH + H CH - CH CH CH + 2 H CH - CH: Właściwości Fizyczne AlkanówNotatkiNo ratings yet
- Porownanie Wlasciwosci Alkoholi 56132Document1 pagePorownanie Wlasciwosci Alkoholi 56132Klaudia KubikNo ratings yet
- Kwasy Karboksylowe I EstryDocument4 pagesKwasy Karboksylowe I EstryBożena Brudka-Gniadkowska100% (3)
- Na Jakie Grupy Dzieli Się Węglowodory?Document17 pagesNa Jakie Grupy Dzieli Się Węglowodory?Mateusz BilińskiNo ratings yet
- MATERIAŁY DYDAKTYCZNE CHEMIA cz.2Document36 pagesMATERIAŁY DYDAKTYCZNE CHEMIA cz.2Zuzia BlubNo ratings yet
- Wymagania Zwiazki Wegla Z WodoremDocument1 pageWymagania Zwiazki Wegla Z Wodoremhubikhubik146No ratings yet
- Estry Kwasów KarboksylowychDocument4 pagesEstry Kwasów KarboksylowychjustynasekulaaNo ratings yet
- Dokument Bez TytułuDocument12 pagesDokument Bez Tytułumg.miksero2.0No ratings yet
- Kwasy OrganiczneDocument9 pagesKwasy OrganiczneAnonNo ratings yet
- WęglowodoryDocument15 pagesWęglowodorysikorskanataliNo ratings yet
- Kwasy Karboksylowe 1Document19 pagesKwasy Karboksylowe 1KDJssNo ratings yet
- BuforDocument3 pagesBuforamelek2005No ratings yet
- TestDocument2 pagesTestKamil BorowicNo ratings yet
- Czym Kwasy Karboksylowe Roznia SDocument29 pagesCzym Kwasy Karboksylowe Roznia SMonika SkorekNo ratings yet
- Jakie Czynniki Wplywaja Na ReaktDocument37 pagesJakie Czynniki Wplywaja Na ReaktWojciech PlichtaNo ratings yet
- Estry - Reakcja EstryfikacjiDocument5 pagesEstry - Reakcja EstryfikacjiAgnieszka MurawskaNo ratings yet
- Lista NR 67Document6 pagesLista NR 67Agnieszka MurawskaNo ratings yet
- Lista PM1Document8 pagesLista PM1Agnieszka MurawskaNo ratings yet
- Mydła PDFDocument2 pagesMydła PDFAgnieszka MurawskaNo ratings yet
- AminyDocument12 pagesAminyAgnieszka MurawskaNo ratings yet
- Zestaw Powtórkowy MetaleDocument6 pagesZestaw Powtórkowy MetaleAgnieszka MurawskaNo ratings yet
- Test 3 Grupa ADocument5 pagesTest 3 Grupa AsiematojakubaaNo ratings yet
- Sciezka SMART Nabor 1 2023 Projekty NegatywneDocument94 pagesSciezka SMART Nabor 1 2023 Projekty Negatywnekamilnowaknowak69No ratings yet
- Cykl MocznikowyDocument4 pagesCykl MocznikowyAmelia RutkowskaNo ratings yet
- Plan OddziałyDocument18 pagesPlan OddziałyLaura KNo ratings yet
Kwasy Karboksylowe - Budowa I Właściwości
Kwasy Karboksylowe - Budowa I Właściwości
Uploaded by
Agnieszka MurawskaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Kwasy Karboksylowe - Budowa I Właściwości
Kwasy Karboksylowe - Budowa I Właściwości
Uploaded by
Agnieszka MurawskaCopyright:
Available Formats
Kwasy karboksylowe - budowa i właściwości.
poniedziałek, 27 lutego 2023 08:00
1. Budowa kwasów karboksylowych:
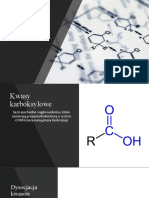
Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową -COOH
zbudowaną z grupy karbonylowej (C=O) i hydroksylowej (OH).
Możemy je podzielić na alifatyczne (grupa alkilowa połączona z grupą karboksylową, np. kwas
butanowy, kwas heptanowy) i aromatyczne (grupa arylowa połączona z grupą karboksylową,
np. kwas benzoesowy).
Najważniejsze nasycone kwasy tłuszczowe to:
▪ C15H31COOH – kwas palmitynowy o wzorze grupowym: CH3–(CH2)14–COOH;
Nowa sekcja 1 Strona 1
▪ C15H31COOH – kwas palmitynowy o wzorze grupowym: CH3–(CH2)14–COOH;
▪ C17H35COOH – kwas stearynowy o wzorze grupowym: CH3–(CH2)16–COOH.
Najważniejszy nienasycony kwas tłuszczowy to kwas oleinowy o wzorze C17H33COOH.
Wiązanie podwójne w cząsteczce tego kwasu występuje pomiędzy 9 a 10 atomem węgla:
CH3–(CH2)7–CH=CH–(CH2)7–COOH.
2. Właściwości kwasów karboksylowych:
Analizując budowę strukturalną kwasów karboksylowych, należałoby oczekiwać, że ich cząsteczki są
polarne (ze względu na obecność hydrofilowej grupy karboksylowej) i wykazują zdolność do
tworzenia wiązań wodorowych między sobą lub z innymi cząsteczkami (np. wody). Idąc tym tropem,
możemy przypuszczać, że kwasy karboksylowe dobrze rozpuszczają się w wodzie. Jednak badania
przekonują, że jedynie kwasy karboksylowe, zawierające od jednego do czterech atomów węgla
w cząsteczce (kwas metanowy, kwas etanowy, kwas propanowy, kwas butanowy), są dobrze
rozpuszczalne w wodzie.
Nowa sekcja 1 Strona 2
Rozpuszczalność wyższych homologów maleje bardzo szybko wraz ze wzrostem długości
łańcucha węglowego, ponieważ zmniejsza się udział hydrofilowej grupy karboksylowej w cząsteczce
na rzecz hydrofobowej reszty węglowodorowej. Kwas zawierający 12 atomów węgla w cząsteczce,
kwas dodekanowy, potocznie zwany kwasem laurynowym, jest praktycznie nierozpuszczalny
w wodzie.
Dysocjacja elektrolityczna (jonowa) kwasów karboksylowych, czyli rozpad cząsteczki na jony pod
wpływem wody.
Nowa sekcja 1 Strona 3
Kwasowość kwasów organicznych wynika z silnej stabilizacji anionu kabroksylanowego,
wywołanego przez rezonans. Ujemny ładunek w obrębie dwóch atomów tlenu anionu
kabroksylowego jest zdelokalizowany. W wyniku czego oba wiązania między atomem węgla
i atomami tlenu są równocenne, a struktury rezonansowe anionu kabroksylanowego równoważne.
--Moc kwasów przekłada się na reaktywność kwasów, czyli zdolność do reagowania, ponieważ
wiele reakcji kwasów organicznych przebiega z udziałem atomu wodoru grupy karboksylowej m.in.
reakcje z: metalami, tlenkami metali, wodorotlenkami metali czy solami słabszych kwasów.
Na moc i reaktywność kwasów karboksylowych wpływa wiele czynników.
Kwasy karboksylowe zbudowane są z dwóch części: polarnej (grupa karboksylowa -COOH)
i niepolarnej (łańcuch węglowodorowy). Im dłuższy jest łańcuch węglowodorowy w cząsteczce
kwasu, tym słabszy jest kwas karboksylowy. Łańcuch węglowodorowy, który jest niepolarny,
stanowi przeszkodę dla grupy karboksylowej, utrudniając jej przeprowadzenie procesu dysocjacji.
Dzięki obecności pierścienia aromatycznego, wzrasta moc kwasów karboksylowych, ponieważ
pierścień aromatyczny stabilizuje anion, który powstał w wyniku dysocjacji. Ujemny ładunek
zostaje zdelokalizowany nie tylko na grupę karboksylową, ale także na cały pierścień
Nowa sekcja 1 Strona 4
zostaje zdelokalizowany nie tylko na grupę karboksylową, ale także na cały pierścień
aromatyczny.
Kwasy karboksylowe, które posiadają wiązania nienasycone są mocniejsze od nasyconych
kwasów karboksylowych.
Wynika to z efektu mezomerycznego, który polega na delokalizacji, czyli przemieszczeniu elektronów
π wiązań wielokrotnych i wolnych par elektronów p (niewiążących) atomu tlenu w grupie
karboksylowej.
Na moc kwasu wpływa również położenie wiązania nienasyconego względem grupy funkcyjnej.
Im bliżej nienasycone wiązanie jest położone względem grupy karboksylowej, tym mocniejszy kwas.
Fluorowiec znajdujący się w pozycji α względem grupy karboksylowej w cząsteczce kwasu,
zdecydowanie zwiększa moc kwasu. Kwas podstawiony fluorowcem w pozycji α jest
najmocniejszym kwasem. Wpływ podstawnika na moc kwasu karboksylowego wynika z efektu
indukcyjnego.
Nowa sekcja 1 Strona 5
Efekt indukcyjny, czyli przesunięcie wspólnej pary elektronów wiązania pojedynczego typu σ
w kierunku atomu bardziej elektroujemnego. Efekt indukcyjny powstaje na skutek różnicy
elektroujemności powiązanych ze sobą atomów różnych pierwiastków, czego konsekwencją jest
polaryzacja wiązania oraz pojawienie się na tych atomach cząstkowych ładunków δ+ i δ-. Efekt
indukcyjny może być przenoszony na odległość około dwóch – trzech wiązań.
Kwasy wielokarboksylowe są lepiej rozpuszczalne w wodzie niż kwasy
monokarboksylowe zawierające tyle samo atomów węgla w cząsteczce. Efekt ten jest
spowodowany przez wzrost ilości hydrofilowych grup karboksylowych, które odpowiadają między
innymi za tworzenie wiązań wodorowych z cząsteczkami wody. Wzrost liczby grup
karboksylowych sprzyja również wzrostowi mocy kwasu. Przykładem kwasu dikarboksylowego
jest kwas etanodiowy (szczawiowy), który, tak jak inne kwasy wielokarboksylowe, ulega
dysocjacji etapowej:
Nowa sekcja 1 Strona 6
Nowa sekcja 1 Strona 7
Nowa sekcja 1 Strona 8
Nowa sekcja 1 Strona 9
You might also like
- Kwasy Karboksylowe - Otrzymywania I ReakcjeDocument5 pagesKwasy Karboksylowe - Otrzymywania I ReakcjeAgnieszka MurawskaNo ratings yet
- Kwasy Karboksylowe - Otrzymywania I ReakcjeDocument5 pagesKwasy Karboksylowe - Otrzymywania I ReakcjeAgnieszka MurawskaNo ratings yet
- 07 - Reakcje W Roztworach WodnychDocument20 pages07 - Reakcje W Roztworach WodnychWiktoria ZachejaNo ratings yet
- Wlasciwosci Fizyczne Zwiazkow Zawierajacych Grupe KarboksylowaDocument27 pagesWlasciwosci Fizyczne Zwiazkow Zawierajacych Grupe KarboksylowaPatrycja ŁotockaNo ratings yet
- Chemia Moc Kwasów OrganicznychDocument5 pagesChemia Moc Kwasów OrganicznychJanina LasNo ratings yet
- Chemia Organiczna - Systematyka Związków Organicznych.Document56 pagesChemia Organiczna - Systematyka Związków Organicznych.wæraNo ratings yet
- Kwasy Karboksylowe - BudowaDocument16 pagesKwasy Karboksylowe - BudowaPoczciwy CypekNo ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinymalenka87No ratings yet
- Chemia NotatkiDocument2 pagesChemia Notatkirafalcisowski842No ratings yet
- Alkany ZuziaDocument17 pagesAlkany ZuziaPiotrek WalczakNo ratings yet
- Wyklad OrganikaDocument80 pagesWyklad Organikamarcelw11No ratings yet
- Weglowodory - PrezentacjaDocument32 pagesWeglowodory - PrezentacjaMarcin MajNo ratings yet
- Chemia Organiczna DefinicjeDocument2 pagesChemia Organiczna DefinicjeGabi PlNo ratings yet
- ZW KarbonDocument46 pagesZW KarbonJan KowalskiNo ratings yet
- Zrzut Ekranu 2024-03-17 o 22.31.03Document186 pagesZrzut Ekranu 2024-03-17 o 22.31.03adamczewskadariaNo ratings yet
- Na Jakie Grupy Dzieli Sie WeglowodoryDocument23 pagesNa Jakie Grupy Dzieli Sie WeglowodoryxpaulisNo ratings yet
- Reakcje Chemicznew Roztworach WodnychDocument14 pagesReakcje Chemicznew Roztworach WodnychJanek LazurNo ratings yet
- Opracowanie 2018Document17 pagesOpracowanie 2018Kuba OlszewskiNo ratings yet
- WDWWDocument34 pagesWDWWMa CieNo ratings yet
- Chemia, Węglowodory, AlkanyDocument3 pagesChemia, Węglowodory, AlkanyDominika CzortekNo ratings yet
- Zaliczenie Z Chemii TechnicznejDocument4 pagesZaliczenie Z Chemii Technicznejolek.siedleckiNo ratings yet
- ChempDocument9 pagesChemppilak.pilak1234No ratings yet
- Szereg Homologiczny Kwasów KarboksylowychDocument2 pagesSzereg Homologiczny Kwasów KarboksylowychAdamNo ratings yet
- Jakie Czynniki Wplywaja Na Reaktywnosc I Moc Kwasow KarboksylowychDocument37 pagesJakie Czynniki Wplywaja Na Reaktywnosc I Moc Kwasow Karboksylowychola112248No ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinyagnik56No ratings yet
- Badanie Wlasciwosci Redukujacych Kwasu Mrowkowego MetanowegoDocument29 pagesBadanie Wlasciwosci Redukujacych Kwasu Mrowkowego MetanowegoEmiliaNo ratings yet
- Weglowodory o Wielokrotnych Wiazaniach Miedzy Atomami Wegla 2Document29 pagesWeglowodory o Wielokrotnych Wiazaniach Miedzy Atomami Wegla 2Влада БережковNo ratings yet
- Notatki Preparatyka WG ZagadnienDocument54 pagesNotatki Preparatyka WG ZagadnienHizuNo ratings yet
- Węglowodany NasyconeDocument5 pagesWęglowodany Nasyconejulita17No ratings yet
- Alkany, Alkiny, AlkenyDocument2 pagesAlkany, Alkiny, AlkenybanucholaNo ratings yet
- Dysocjacja Elektrolityczna KwasówDocument12 pagesDysocjacja Elektrolityczna Kwasówvanessa.poeckh13No ratings yet
- Alkany Alkeny AlkinyDocument35 pagesAlkany Alkeny Alkinyiwonkasia100% (5)
- 6 4-NoteDocument3 pages6 4-Notewikaa aaNo ratings yet
- Chemia Klasa 8 Temat Podsumowanie - Pochodne WęglowodorówDocument8 pagesChemia Klasa 8 Temat Podsumowanie - Pochodne WęglowodorówfavortojaNo ratings yet
- Akwa - Amina - I HydroksokompleksyDocument18 pagesAkwa - Amina - I HydroksokompleksyWiktoria Frania NowakNo ratings yet
- Badanie Wlasciwosci RedukujacychDocument24 pagesBadanie Wlasciwosci RedukujacychDiesel PowerNo ratings yet
- Alkohole Kwasy Karboksylowe Estry Aminy Aminokwasy SprawdzianDocument2 pagesAlkohole Kwasy Karboksylowe Estry Aminy Aminokwasy SprawdzianPAN PAWEŁ0% (4)
- Reaktywność ArenówDocument23 pagesReaktywność ArenówErica MyersNo ratings yet
- Porownywanie Mocy Kwasow Karboksylowych I NieorganicznychDocument27 pagesPorownywanie Mocy Kwasow Karboksylowych I NieorganicznychJulia SakowiczNo ratings yet
- Kwasy KarboksyloweDocument11 pagesKwasy KarboksylowehankuczerwNo ratings yet
- KwasyDocument3 pagesKwasysukinsynNo ratings yet
- Chemia Ładunkowa ćw1Document3 pagesChemia Ładunkowa ćw1Łukasz JońskiNo ratings yet
- Sulfonowanie BenzenuDocument17 pagesSulfonowanie BenzenuOla MachowskaNo ratings yet
- W Jaki Sposob Zapisuje Sie Wzory Soli Kwasow KarboksylowychDocument16 pagesW Jaki Sposob Zapisuje Sie Wzory Soli Kwasow Karboksylowychpatrycja.chmuraaNo ratings yet
- 2dysocjacja ElektrolitycznaDocument4 pages2dysocjacja ElektrolitycznaNatalia WojewódkaNo ratings yet
- CH CH + H CH - CH CH CH + 2 H CH - CH: Właściwości Fizyczne AlkanówDocument1 pageCH CH + H CH - CH CH CH + 2 H CH - CH: Właściwości Fizyczne AlkanówNotatkiNo ratings yet
- Porownanie Wlasciwosci Alkoholi 56132Document1 pagePorownanie Wlasciwosci Alkoholi 56132Klaudia KubikNo ratings yet
- Kwasy Karboksylowe I EstryDocument4 pagesKwasy Karboksylowe I EstryBożena Brudka-Gniadkowska100% (3)
- Na Jakie Grupy Dzieli Się Węglowodory?Document17 pagesNa Jakie Grupy Dzieli Się Węglowodory?Mateusz BilińskiNo ratings yet
- MATERIAŁY DYDAKTYCZNE CHEMIA cz.2Document36 pagesMATERIAŁY DYDAKTYCZNE CHEMIA cz.2Zuzia BlubNo ratings yet
- Wymagania Zwiazki Wegla Z WodoremDocument1 pageWymagania Zwiazki Wegla Z Wodoremhubikhubik146No ratings yet
- Estry Kwasów KarboksylowychDocument4 pagesEstry Kwasów KarboksylowychjustynasekulaaNo ratings yet
- Dokument Bez TytułuDocument12 pagesDokument Bez Tytułumg.miksero2.0No ratings yet
- Kwasy OrganiczneDocument9 pagesKwasy OrganiczneAnonNo ratings yet
- WęglowodoryDocument15 pagesWęglowodorysikorskanataliNo ratings yet
- Kwasy Karboksylowe 1Document19 pagesKwasy Karboksylowe 1KDJssNo ratings yet
- BuforDocument3 pagesBuforamelek2005No ratings yet
- TestDocument2 pagesTestKamil BorowicNo ratings yet
- Czym Kwasy Karboksylowe Roznia SDocument29 pagesCzym Kwasy Karboksylowe Roznia SMonika SkorekNo ratings yet
- Jakie Czynniki Wplywaja Na ReaktDocument37 pagesJakie Czynniki Wplywaja Na ReaktWojciech PlichtaNo ratings yet
- Estry - Reakcja EstryfikacjiDocument5 pagesEstry - Reakcja EstryfikacjiAgnieszka MurawskaNo ratings yet
- Lista NR 67Document6 pagesLista NR 67Agnieszka MurawskaNo ratings yet
- Lista PM1Document8 pagesLista PM1Agnieszka MurawskaNo ratings yet
- Mydła PDFDocument2 pagesMydła PDFAgnieszka MurawskaNo ratings yet
- AminyDocument12 pagesAminyAgnieszka MurawskaNo ratings yet
- Zestaw Powtórkowy MetaleDocument6 pagesZestaw Powtórkowy MetaleAgnieszka MurawskaNo ratings yet
- Test 3 Grupa ADocument5 pagesTest 3 Grupa AsiematojakubaaNo ratings yet
- Sciezka SMART Nabor 1 2023 Projekty NegatywneDocument94 pagesSciezka SMART Nabor 1 2023 Projekty Negatywnekamilnowaknowak69No ratings yet
- Cykl MocznikowyDocument4 pagesCykl MocznikowyAmelia RutkowskaNo ratings yet
- Plan OddziałyDocument18 pagesPlan OddziałyLaura KNo ratings yet