Professional Documents
Culture Documents
Correction Série 4 $ Suivi Temporel D'une Transformation 2bac Ar
Correction Série 4 $ Suivi Temporel D'une Transformation 2bac Ar
Uploaded by
Ayoub ImgirneOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Correction Série 4 $ Suivi Temporel D'une Transformation 2bac Ar
Correction Série 4 $ Suivi Temporel D'une Transformation 2bac Ar
Uploaded by
Ayoub ImgirneCopyright:
Available Formats
Www.AdrarPhysic.
Com
ﺗﻤﺮﻳﻦ :1
: ﻣن اﻟﻣﺣﻠول -1ﻛﺗﻠﺔ ﺑﻠورات ﺣﻣض اﻷوﻛﺳﺎﻟﯾك اﻻزﻣﺔ ﻟﺗﺣﺿﯾر
ﻟدﯾﻧﺎ :
= = .
⇒ ⇒ = . . ( )
= .
=
= . × (× × , + × + × )= , × ﺗطﺑﯾق ﻋددي :
-1-2ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ﺑﯾن اﻟﻣزدوﺟﺗﯾن :
( )+ ( )+ ⇄ ( )+ )( : ) ( ) (
) ×( ⇄ (+ ( )+
) : ⁄
----------------------------------------------------------------------
( )+ ( ) + ⇄ ) ( + ( )+ )(
-2-2ﺗﻌرﯾف اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ :
ﺗﻌرف اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻟﻠﺗﻔﺎﻋل ﺑﺎﻟﻌﻼﻗﺔ اﻟﺗﺎﻟﯾﺔ :
= .
ﺣﯾث :ھو ﺣﺟم اﻟﺧﻠﯾط اﻟﺗﻔﺎﻋﻠﻲ
و ﻣﺷﺗﻘﺔ اﻟﺗﻘدم ﺑﺎﻟﻧﺳﺑﺔ ﻟﻠزﻣن
[: -ﺗﻌﺑﯾر اﻟﺳرﻋﺔ ﺑدﻻﻟﺔ ]
[ =] ( ⇒ [=) ]. ﻣﻊ : = ( أي: =) ﺣﺳب ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ﻧﻛﺗب :
وﻣﻧﮫ :
( ) [ ]. [ ]. [ ]
= = ⇒ = = .
[ ] [ ]
= . . = ⇒ .
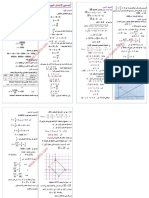
-3-2ﺣﺳﺎب ﺳرﻋﺔ اﻟﺗﻔﺎﻋل ﻋﻧد : t=0
ﻧﺣﺳب اﻟﻣﻌﺎﻣل اﻟﻣوﺟﮫ ﻟﻠﻣﻣﺎس : T
[∆ ] −
= = = , . .
∆ . −
=) = ( = , . .
ﺣﺳﺎب ﺳرﻋﺔ اﻟﺗﻔﺎﻋل ﻋﻧد : t=50s
ﻧﺣﺳب اﻟﻣﻌﺎﻣل اﻟﻣوﺟﮫ ﻟﻠﻣﻣﺎس ’: T
[∆ ] −
= = = , . .
∆ − ,
= ( =) = , . .
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
Www.AdrarPhysic.Com
: -4-2اﻟﺣد اﻟذي ﯾؤول إﻟﯾﮫ ﺗرﻛﯾز أﯾوﻧﺎت
ﻧﻧﺟز اﻟﺟدول اﻟوﺻﻔﻲ ﻟﺗﻘدم اﻟﺗﻔﺎﻋل :
ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ( ) + ( ) + ( ⇄ ) + ( ) + )(
اﻟﺗﻘدم ﺣﺎﻟﺔ اﻟﻣﺟﻣوﻋﺔ ﻛﻣﯾﺎت اﻟﻣﺎدة ب
اﻟﺑدﺋﯾﺔ , −وﻓﯾر وﻓﯾر
اﻟﺑﯾﻧﯾﺔ − , − −وﻓﯾر وﻓﯾر
اﻟﻧﮭﺎﺋﯾﺔ − , − −وﻓﯾر وﻓﯾر
ﺣﺳب اﻟﺟدول اﻟوﺻﻔﻲ :
= إذا ﻛﺎن اﻟﻣﺗﻔﺎﻋل اﻟﻣﺣد ھو ﺣﻣض اﻻوﻛﺳﺎﻟﯾك ﯾﻛون
= , إذا ﻛﺎن اﻟﻣﺗﻔﺎﻋل اﻟﻣﺣد ھو أﯾوﻧﺎت ﺛﻧﺎﺋﻲ ﻛروﻣﺎت ﯾﻛون :
= , ﻓﺈن اﻟﺗﻘدم اﻻﻗﺻﻰ ھو : < ﺑﻣﺎ أن :
( =) = , ﺣﺳب اﻟﺟدول اﻟوﺻﻔﻲ :
اﻟﺣد اﻟذي ﯾؤول إﻟﯾﮫ ﺗرﻛﯾز أﯾوﻧﺎت اﻟﻛروات ھو :
( ) ,
[ = ] = = , .
,
-اﺳﺗﻧﺗﺎج زﻣن ﻧﺻف اﻟﺗﻔﺎﻋل :
⁄ = ﻧﺣﺻل ﻋﻠﻰ زﻣن ﻧﺻف اﻟﺗﻔﺎﻋل ﻋﻧدﻣﺎ ﯾﺻﺑﺢ اﻟﺗﻘدم xﯾﺳﺎوي :
[ ] ⁄ = = = , . ﯾﻛون : أي أن ﺗرﻛﯾز أﯾوﻧﺎت
⁄ ≈ ﻣﺑﯾﺎﻧﯾﺎ وﺑﺎﺳﺗﻌﻣﺎل اﻻﺳﻘﺎط ﻧﺣﺻل ﻋﻠﻰ ,
-5-2ﻣن ﺧﻼل ﺗﻣﺛﯾل اﻟﻣﻣﺎس ﻓﻲ ﻟﺣظﺎت ﻣﺧﺗﻠﻔﺔ ﯾﺗﺑﯾن أن ﻣﻌﺎﻣﻠﮫ اﻟﻣوﺟﮫ ﯾﺗﻧﺎﻗص ﻣﻊ اﻟزﻣن ،وﺑﻣﺎ أن ﺣﺟم اﻟﺧﻠﯾط ﯾﺑﻘﻰ ﺛﺎﺑﺗﺎ ﺧﻼل اﻟﺗﻔﺎﻋل
ﻓﺈن اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﺗﺗﻧﺎﻗص ﺧﻼل اﻟﺗﻔﺎﻋل اﻟﻰ أن ﺗﻧﻌدم ﻋﻧد ﻧﮭﺎﯾﺗﮫ.
ﺗﻣرﯾن :2
-1ﺣﺳﺎب ﻛﺛﺎﻓﺔ ﻏﺎز ﺛﻧﺎﺋﻲ أوﻛﺳﯾد اﻟﻛرﺑون :
( ) + ×
= = = , <
ﻛﺛﺎﻓﺔ ﻏﺎز ﺛﻧﺎﺋﻲ أوﻛﺳﯾد اﻟﻛرﺑون أﻛﺛر ﻣن اﻟﮭواء )أي أﻧﮫ أﺛﻘل ﻣن اﻟﮭواء( وﺑﺎﻟﺗﺎﻟﻲ ﻓﮭو ﯾﺗﺟﻣﻊ ﻓﻲ أﺳﻔل اﻟﻣﻐﺎرة .
-2ﺣﺳﺎب ﻛﻣﯾﺔ ﻣﺎدة اﻟﻣﺗﻔﺎﻋﻼت اﻟﺑدﺋﯾﺔ :
-ﺑﺎﻟﻧﺳﺑﺔ ﻷﯾون اﻷوﻛﺳوﻧﯾوم :
( )= . = , × , = , .
-ﺑﺎﻟﻧﺳﺑﺔ ﻟﻛرﺑوﻧﺎت اﻟﻛﺎﻟﺳﯾوم :
( =) = = , .
( ) + + ×
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
Www.AdrarPhysic.Com
-3ﺟدول اﻟﺗﻘدم :
ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ( ) + ( → ) ( ) + ( ) + ( )
ﺣﺎﻟﺔ اﻟﻣﺟﻣوﻋﺔ اﻟﺗﻘدم ﻛﻣﯾﺎة اﻟﻣﺎدة ب
اﻟﺣﺎﻟﺔ اﻟﺑدﺋﯾﺔ , . , . ﺑوﻓرة
اﻟﺣﺎﻟﺔ اﻟوﺳﯾطﯾﺔ , . − , . − ﺑوﻓرة
اﻟﺣﺎﻟﺔ اﻟﻧﮭﺎﺋﯾﺔ , . − , . − ﺑوﻓرة
= . , .أي: − = -إذا ﻛﺎن أﯾون اﻻوﻛﺳوﻧﯾوم ھو اﻟﻣﺗﻔﺎﻋل اﻟﻣﺣد ،ﻓﺈن:
= , . , .أي: − = -إذا ﻛﺎن أﯾون ﻛرﺑوﻧﺎت اﻟﻛﺎﻟﺳﯾوم ھو اﻟﻣﺗﻔﺎﻋل اﻟﻣﺣد ،ﻓﺈن:
= . واﻟﺗﻘدم اﻻﻗﺻﻰ ھو اﻟﻣﺗﻔﺎﻋل اﻟﻣﺣد ھو أﯾون < ﺑﻣﺎ أن :
-1-4ﺑﺎﺳﺗﻌﻣﺎل ﻣﻌﺎدﻟﺔ اﻟﻐﺎزات اﻟﻛﺎﻣﻠﺔ ﻧﻛﺗب :
. ( = )∗( ). .
( =) ﺣﺳب اﻟﺟدول اﻟوﺻﻔﻲ :
اﻟﻌﻼﻗﺔ )∗( ﺗﻛﺗب :
.
= .
أي (∗∗) : . = . .
= : -ﺣﺳﺎب اﻟﺗﻘدم ﻋﻧد اﻟﻠﺣظﺔ
= = . ﺣﺳب ﺟدول اﻟﻘﯾﺎﺳﺎت ﻧﺟد ﻋﻧد ھذه اﻟﻠﺣظﺔ اﻟﺣﺟم :
اﻟﻌﻼﻗﺔ )∗∗( ﺗﻛﺗب :
, . × .
= ≈ , .
, ×
-2-4اﻟﺣﺟم اﻟﻘﺻوي اﻟﻣﻣﻛن اﻟﺣﺻول ﻋﻠﯾﮫ ﻓﻲ ھذه اﻟﺗﺟرﺑﺔ :
. . . × , ×
= ⇒
= = , . =
, .
ﯾﺳﺎوي اﻟﺣﺟم اﻟﻘﺻوي وﺑﺎﻟﺗﺎﻟﻲ اﻟﺗﻔﺎﻋل ﻛﻠﻲ . ﻣن ﺧﻼل ﺟدول اﻟﻘﯾﺎﺳﺎت ﻧﻼﺣظ أن اﻟﺣﺟم اﻟﻧﮭﺎﺋﻲ ﻟﻐﺎز
=
=
-1-5ﺗﻌﺑﯾر اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻟﻠﺗﻔﺎﻋل :
= .
ﻣﺷﺗﻘﺔ اﻟﺗﻘدم ﺑﺎﻟﻧﺳﺑﺔ ﻟﻠزﻣن . :ﺣﺟم اﻟﺧﻠﯾط اﻟﺗﻔﺎﻋﻠﻲ و ﺣﯾث
ﺑﻣﺎ أن ﺣﺟم اﻟﺧﻠﯾط ﯾﺑﻘﻰ ﺛﺎﺑﺗﺎ ﺧﻼل اﻟﺗﻔﺎﻋل واﻟﻣﻌﺎﻣل اﻟﻣوﺟﮫ ﻟﻣﻣﺎس اﻟﻣﻧﺣﻧﻰ ﯾﺗﻧﺎﻗص ﻣﻊ اﻟزﻣن ،ﻓﺈن اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻟﻠﺗﻔﺎﻋل ﺗﺗﻧﺎﻗص
ﻣﻊ اﻟزﻣن اﻟﻰ أن ﺗﻧﻌدم ﻋﻧد ﻧﮭﺎﯾﺔ اﻟﺗﻔﺎﻋل .
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
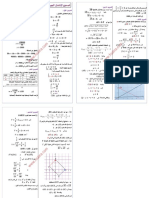
-2-5ﺗﻌرﯾف زﻣن ﻧﺻف اﻟﺗﻔﺎﻋل :
ھو اﻟﻣدة اﻟزﻣﻧﯾﺔ اﻟﺗﻲ ﻋﻧد ﺗﻣﺎﻣﮭﺎ ﯾﺻل اﻟﺗﻘدم اﻟﻰ ﻧﺻف ﻗﯾﻣﺗﮫ اﻟﻧﮭﺎﺋﯾﺔ .
⁄ = = , . أي :ﻋﻧد = ⁄ﻟدﯾﻧﺎ :
≈ ⁄ ﻣﺑﯾﺎﻧﯾﺎ ﻧﺟد :
= وﻗﯾﻣﺗﮭﺎ ﺳﺗﻛون أﻗل ﻣن اﻟﺣﺎﻟﺔ -1-6ﺑﻣﺎ أن درﺟﺔ اﻟﺣرارة ﻋﺎﻣل ﺣرﻛﻲ ﻓﻌﻧد اﻧﺧﻔﺎض درﺟﺔ اﻟﺣرارة ﺳﺗﻧﻧﺧﻔض اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻋﻧد
اﻻوﻟﻰ .
-2-6أﻧظر اﻟﺷﻛل أﻋﻼه .
( ) و أﯾون اﻟﻛﺎﻟﺳﯾوم ( ) أﯾون اﻻوﻛﺳوﻧﯾوم ( )-1-7ﺟرد اﻷﯾوﻧﺎت اﻟﻣﺗواﺟدة ﻓﻲ اﻟﻣﺣﻠول :أﯾون اﻟﻛﻠورور
اﻷﯾون اﻟذي ﻻ ﯾﺗدﺧل ﻓﻲ اﻟﺗﻔﺎﻋل ھو أﯾون اﻟﻛﻠورور ) ( .
-2-7ﻣن ﺧﻼل ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ﻧﻼﺣظ ان ﺗﻛون ﻣول واﺣد ﻣن أﯾون اﻟﻛﺎﻟﺳﯾوم ﯾؤدي اﻟﻰ اﺧﺗﻔﺎء ﻣوﻟﯾن ﻣن أﯾون اﻻوﻛﺳوﻧﯾوم وﺑﻣﺎ أن
وﺑﺎﻟﺗﺎﻟﻲ ﻣوﺻﻠﯾﺔ اﻟﻣﺣﻠول ﺗﺗﻧﺎﻗص . ≫
-3-7ﺣﺳﺎب ﻣوﺻﻠﯾﺔ اﻟﻣﺣﻠول ﻋﻧد : t=0
ﻟم ﺗﺗﻛون ﺑﻌد .ﻣوﺻﻠﯾﺔ اﻟﻣﺣﻠول ﺗﻛﺗب : ( وأﯾوﻧﺎت
) ( ) و ( ) ﻋﻧد ھذه اﻟﻠﺣظﺔ اﻻﯾوﻧﺎت اﻟﻣﺗواﺟدة ﻓﻲ اﻟﻣﺣﻠول ھﻲ :
[ ﻧﻛﺗب : [= ] = ] ﻣﻊ : = [ ] + [ ]
= + = , . . (× , + , ). . . = , .
= , − -4-7إﺛﺑﺎت اﻟﻌﻼﻗﺔ :
ﻣوﺻﻠﯾﺔ اﻟﻣﺣﻠول ﻋﻧد اﻟﻠﺣظﺔ tﺗﻛﺗب :
= [ ]+ [ ]+ [ ]
ﺣﺳب اﻟﺟدول اﻟوﺻﻔﻲ :
.
[ =] [ و =] [ و =]
. −
= + . + ⇒ = + + −
= + −
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
ت.ع:
= , . + (× , − × ×) , . . = , −
, .
: -5-7ﺣﺳﺎب ﻣوﺻﻠﯾﺔ اﻟﻣﺣﻠول ﻋﻧد
= , − ⇒ = , − × . = , .
ﺗﻣرﯾن : 3
-1ﻣﻌﺎدﻟﺔ ﺗﻔﺎﻋل اﻷﻛﺳدة –اﺧﺗزال :
( ) + ( → ) ( ) + ( )
-2ﻛﻣﯾﺔ ﻣﺎدة اﻟﻣﺗﻔﺎﻋﻠﯾن واﻟﺗرﻛﯾز اﻟﺑدﺋﻲ ﻟﻠﻣﺗﻔﺎﻋﻠﯾن ﻓﻲ اﻟﺧﻠﯾط :
( =) . = . × , = , .
=) ( . = . × , = , .
( ) , .
= = = , . .
+ , + ,
) ( , .
[ = ] = = , . .
+ , + ,
-3ﺟدول ﺗﻘدم اﻟﺗﻔﺎﻋل :
ﻣﻌﺎدﻟﺔ اﻟﺗﻔﺎﻋل ( ) + ( → ) ( ) + ( )
ﺣﺎﻟﺔ اﻟﻣﺟﻣوﻋﺔ اﻟﺗﻘدم ﻛﻣﯾﺎت اﻟﻣﺎدة ب )(mol
اﻟﺣﺎﻟﺔ اﻟﺑدﺋﯾﺔ , . .
اﻟﺣﺎﻟﺔ اﻟوﺳﯾطﯾﺔ , . − . −
اﻟﺣﺎﻟﺔ اﻟﻧﮭﺎﺋﯾﺔ , . − . −
اﻟﺗﻘدم اﻻﻗﺻﻰ :
( ) , . ( )
= = . و = , . ﻧﻘﺎرن اﻟﻧﺳﺑﺗﯾن :
= . وﺑﺎﻟﺗﺎﻟﻲ اﻟﺗﻘدم اﻻﻗﺻﻰ ھو :
-4اﻟطرق اﻟﺗﻲ ﺗﻣﻛن ﻣن ﺗﺗﺑﻊ ﺗطور اﻟﻣﺟﻣوﻋﺔ اﻟﻛﯾﻣﯾﺎﺋﯾﺔ اﻟﻣدروﺳﺔ ھﻲ :
-اﻟﻣوﺻﻠﯾﺔ
-اﻟﻣﻌﺎﯾرة
-1-5ﻧﺑرد اﻟﻌﯾﻧﺔ ﻓﻲ اﻟﻣﺎء اﻟﻣﺛﻠﺞ ﻹﯾﻘﺎف ﺗطور اﻟﺗﻔﺎﻋل )ﺗﺳﻣﻰ ھذه اﻟﻌﻣﻠﯾﺔ اﻟﻐطس (
-2-5ﻣﻌﺎدﻟﺔ ﺗﻔﺎﻋل اﻟﻣﻌﺎﯾرة :
( ) + ( ) → ( ) + ( )
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
: -6ﺗﻌﺑﯾر اﻟﺗراﻛﯾز اﻟﻣوﻟﯾﺔ ﻟﻠﻣﺗﻔﺎﻋﻼت و اﻟﻧواﺗﺞ ﺑدﻻﻟﺔ اﻟﺗﻘدم
ﺑﺎﻻﺳﺗﻌﺎﻧﺔ ﺑﺎﻟﺟدول اﻟوﺻﻔﻲ ﻧﻛﺗب :
− −
( ) ( ) . − ( ) , . −
[ ]=، = = =] [ ، = ، = =
) (
=
-7ﺗﻌﺑﯾر اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﺑدﻻﻟﺔ ﺗرﻛﯾز ﺛﻧﺎﺋﻲ اﻟﯾود :
ﺣﺳب ﺗﻌرﯾف اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ :
= .
= ] [ أي = . [ ] : و = + ﻣﻊ :
)] [ ( . ] [
= = .
] [
= ﻧﻌوض ﻓﻲ ﺗﻌﺑﯾر اﻟﺳرﻋﺔ ﻧﺟد :
ﻟﺣﺳﺎب اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻋﻧد اﻟﻠﺣظﺔ t=0ﻧﺣدد اﻟﻣﻌﺎﻣل اﻟﻣوﺟﮫ ﻟﻠﻣﺎس T1ﻟﻠﻣﻧﺣﻧﻰ ﻋﻧد ﻧﻔس اﻟﻠﺣظﺔ :
] [ ] [∆ , .
= = = = , . . = , . . .
∆
-8زﻣن ﻧﺻف اﻟﺗﻔﺎﻋل ھو اﻟﻣدة اﻟﻼزﻣﺔ ﻟﻛﻲ ﯾﺻل
. اﻟﺗﻘدم ﻧﺻف ﻗﯾﻣﺗﮫ اﻟﻧﮭﺎﺋﯾﺔ
= ﻧﻌﻠم أن ﻗﯾﻣﺔ اﻟﺗﻘدم اﻻﻗﺻﻰ =
] [ .وھﻲ ﺗواﻓق = :
. = . .
⁄ = = . ﻋﻧد اﻟﺗﻘدم
اﻧظر اﻟﻣﺑﯾﺎن . = ⁄ ﻧﺟد ﻣﺑﯾﺎﻧﯾﺎ :
اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻋﻧد اﻟﻠﺣظﺔ : t=80 min
ﺗﻛون اﻟﺳرﻋﺔ ﻣﻧﻌدﻣﺔ ﻋﻧد ھذه اﻟﻠﺣظﺔ ﻷن ﻣﻣﺎس
اﻟﻣﻧﺣﻧﻰ ﯾﻛون أﻓﻘﯾﺎ وﻣﻌﺎﻣﻠﮫ اﻟﻣوﺟﮫ ﯾﻛون ﻣﻧﻌدﻣﺎ .
] [
= =
( ﻷن ﺗراﻛﯾز اﻟﻣﺗﻔﺎﻋﻼت اﻟﺗﻲ ﺗﺗﻧﺎﻗص ھﻲ ﻋﺎﻣل ﺣرﻛﻲ > -9اﻟﺳرﻋﺔ اﻟﺣﺟﻣﯾﺔ ﻟﺗﻛون ﺛﻧﺎﺋﻲ اﻟﯾود ﺗﺗﻧﺎﻗص ﺧﻼل اﻟزﻣن )
ﻟﻠﺗﻔﺎﻋل .
-10اﻟﻌواﻣل اﻟﺣرﻛﯾﺔ اﻟﺗﻲ ﺗﻣﻛن ﻣن ﺗﻐﯾﯾر ﺳرﻋﺔ اﻟﺗﻔﺎﻋل ھﻲ :
-اﻟﺗرﻛﯾز اﻟﺑدﺋﻲ ﻟﻠﻣﺗﻔﺎﻋﻼت
ﻣﻠﺣوظﺔ :
اﻟﺣﻔﺎز ﯾؤﺛر ﻋﻠﻰ ﺳرﻋﺔ اﻟﺗﻔﺎﻋل ﻟﻛﻧﮫ ﻟﯾس ﺑﻌﺎﻣل ﺣرﻛﻲ .
ﻣﻧﺗدﯾﺎت ﻋﻠوم اﻟﺣﯾﺎة واﻻرض ﺑﺄﺻﯾﻠﺔ
You might also like
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tshih Slsla Altmarin 2 1 PDFDocument6 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tshih Slsla Altmarin 2 1 PDFIbrahím LaâmëchNo ratings yet
- 22alfiziaa Oalkimiaa Alom Fiziaiia 2013 Aldora Alaadia Altshih 1Document9 pages22alfiziaa Oalkimiaa Alom Fiziaiia 2013 Aldora Alaadia Altshih 1Youssef YoussefNo ratings yet
- DM1 3sa2023Document2 pagesDM1 3sa2023bac 2023No ratings yet
- الامتحان الوطني في الفيزياء والكيمياء 2009 مسلك علوم فيزيائية الدورة الاستدراكيةDocument14 pagesالامتحان الوطني في الفيزياء والكيمياء 2009 مسلك علوم فيزيائية الدورة الاستدراكيةThe King. YTNo ratings yet
- تصحيح اختبار الفصل الثاني -الرياضيات -الأولى متوسطDocument3 pagesتصحيح اختبار الفصل الثاني -الرياضيات -الأولى متوسطPęr DüNo ratings yet
- TP 1-24-Arabe-Introduction-À Matlab - 240217 - 090708Document2 pagesTP 1-24-Arabe-Introduction-À Matlab - 240217 - 090708cpt123555No ratings yet
- Bac 2023 Ge MathDocument4 pagesBac 2023 Ge MathhecinbendahNo ratings yet
- Démonstration 01Document8 pagesDémonstration 01Locke LamoraNo ratings yet
- تصحيح 2018Document2 pagesتصحيح 2018متفا ئلNo ratings yet
- تصحيح 2018Document2 pagesتصحيح 2018متفا ئلNo ratings yet
- رياضيات الاستاذة مالكيDocument5 pagesرياضيات الاستاذة مالكيhamamaNo ratings yet
- تجريبي رياضياتDocument2 pagesتجريبي رياضياتRedouane MerijiNo ratings yet
- Dzexams Bac Mathematiques 572285Document11 pagesDzexams Bac Mathematiques 572285bureau.secretariat16No ratings yet
- Dzexams Bac Mathematiques 572285Document11 pagesDzexams Bac Mathematiques 572285Salah BELKATEBNo ratings yet
- الفيزياء والكيمياء 2009Document13 pagesالفيزياء والكيمياء 2009ayoubhalbarik88No ratings yet
- تمارين حول المعادلات والمتراجحات 1-8-9Document2 pagesتمارين حول المعادلات والمتراجحات 1-8-9Rii Ma SaiNo ratings yet
- 06Document4 pages06errab2012No ratings yet
- الامتحان + التصحيحDocument6 pagesالامتحان + التصحيحXrg WahabNo ratings yet
- الامتحان + التصحيحDocument6 pagesالامتحان + التصحيحXrg WahabNo ratings yet
- Math 3se23 1trim11Document4 pagesMath 3se23 1trim11Nawel wiwi BoualiNo ratings yet
- تقويم تشخيصيDocument2 pagesتقويم تشخيصيNouh NahnouhNo ratings yet
- سلسلة تمارين حول النهايايات و دراسة الدوال PDFDocument6 pagesسلسلة تمارين حول النهايايات و دراسة الدوال PDFMimi MiraNo ratings yet
- Bac Se Math 2022Document4 pagesBac Se Math 2022Ahlem AhlemNo ratings yet
- Modakira 3Document1 pageModakira 3ⴰⴱⵓ ⴰⵍⴰⴻNo ratings yet
- Modakira 3Document1 pageModakira 3ⴰⴱⵓ ⴰⵍⴰⴻNo ratings yet
- 3AS Devoir 2TrDocument2 pages3AS Devoir 2Tritz chakibNo ratings yet
- ملخص الاحصاء + تمارين مع الحل في الرياضيات للسنة الثالثة ثانوي شعبة تسيير و اقتصادDocument46 pagesملخص الاحصاء + تمارين مع الحل في الرياضيات للسنة الثالثة ثانوي شعبة تسيير و اقتصادYaCiNe DZNo ratings yet
- تصحيح عادية 15Document8 pagesتصحيح عادية 15ANASS ELYAAKOUBYNo ratings yet
- 2018_revision_01-1hhhhhhr2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhhDocument3 pages2018_revision_01-1hhhhhhr2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhh2018_revision_01-1hhhhhhCry FelinaNo ratings yet
- محاضراتDocument15 pagesمحاضراتTinhinane TouzoutiNo ratings yet
- Fonctions 1asDocument2 pagesFonctions 1asMassi HassaniNo ratings yet
- Math 3se23 3trim13Document6 pagesMath 3se23 3trim13moundherkhadraoui145No ratings yet
- النشاط 2 رياضيات 2Document2 pagesالنشاط 2 رياضيات 2mouniraroseNo ratings yet
- Examen 3Document2 pagesExamen 3Radi ToufikNo ratings yet
- Math 3se22 1trim1Document2 pagesMath 3se22 1trim1karim badkrNo ratings yet
- CORR PC2015NS SC.P (Pc1.ma)Document7 pagesCORR PC2015NS SC.P (Pc1.ma)Khalid atibNo ratings yet
- �جبر 1 - نسخةDocument60 pages�جبر 1 - نسخةsaleh776679491No ratings yet
- BAC 2020 Sujet1Document1 pageBAC 2020 Sujet1aammmohamad655No ratings yet
- BAC 2020 Sujet1Document1 pageBAC 2020 Sujet1aammmohamad655No ratings yet
- تطبيقات نظرية التقدير إحصاء 3 ثانية ليسانس جميع الشعبDocument6 pagesتطبيقات نظرية التقدير إحصاء 3 ثانية ليسانس جميع الشعبnardjes drifoulNo ratings yet
- Compo - 3as - S Exp - 2012 - 2013Document2 pagesCompo - 3as - S Exp - 2012 - 2013Amar HamzaNo ratings yet
- Dzexams Docs 2as 904584Document32 pagesDzexams Docs 2as 904584hamamaNo ratings yet
- Bac SC Math 2021Document4 pagesBac SC Math 2021abdelleh ferroudjNo ratings yet
- Bac SC Math 2021Document4 pagesBac SC Math 2021Kerboub IdrisNo ratings yet
- حل السلسلة الثالثةDocument7 pagesحل السلسلة الثالثةaymannessal62No ratings yet
- Cours 04 4Document3 pagesCours 04 4Ouali MokhtariNo ratings yet
- السلسلة التمهيدية رقم 01Document2 pagesالسلسلة التمهيدية رقم 01hamoudiali19200No ratings yet
- 1 - فرض منزلي من اقتراح الاستاذ عبدالله بن لختيرDocument1 page1 - فرض منزلي من اقتراح الاستاذ عبدالله بن لختيرHaytam BadaNo ratings yet
- مراجعة عامة للمنهجDocument7 pagesمراجعة عامة للمنهججوديNo ratings yet
- A3dad Morakaba Bac 2011Document2 pagesA3dad Morakaba Bac 2011Yacine MontréalNo ratings yet
- Bac Ge Math 2022Document4 pagesBac Ge Math 2022Fatima MelNo ratings yet
- c6 2sc Log PDFDocument4 pagesc6 2sc Log PDFMOhmmed taawytNo ratings yet
- 14- طرق حل المعادلات آنيا بالحذف والتعويضDocument4 pages14- طرق حل المعادلات آنيا بالحذف والتعويضkfmath67% (3)
- مسألة 16 مجلة الأستاذ سرخاد عبدالباسطDocument2 pagesمسألة 16 مجلة الأستاذ سرخاد عبدالباسطGI 2 Session 2018-2019100% (1)
- الامتحان الأول ثانوية بوشوشة 2021Document3 pagesالامتحان الأول ثانوية بوشوشة 2021الأستاذ قاسمNo ratings yet
- حل تمارين الناقلية. - استعد باكpdfDocument23 pagesحل تمارين الناقلية. - استعد باكpdfSe LmaNo ratings yet
- حل تمارين الناقلية. - استعد باكpdfDocument23 pagesحل تمارين الناقلية. - استعد باكpdfĂð ĘmNo ratings yet
- Exam BlancDocument3 pagesExam BlancBadr HobariNo ratings yet
- تمرين متتاليات شامل رقم -1- مع الحلDocument11 pagesتمرين متتاليات شامل رقم -1- مع الحلMellah ImadNo ratings yet
- التدريس فن وعلمDocument404 pagesالتدريس فن وعلمAyoub ImgirneNo ratings yet
- Correction Série 4 $ Ondes Périodiques 2bac ArDocument4 pagesCorrection Série 4 $ Ondes Périodiques 2bac ArAyoub Imgirne100% (1)
- Série 3 $ Suivi Temporel D'une Transformation 2bac ArDocument4 pagesSérie 3 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- Série 4 $ Suivi Temporel D'une Transformation 2bac ArDocument3 pagesSérie 4 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- ا د م ا ا 0 ا x ا x ا S + 2 ل ' ةد ا ت آ م ا 0 5.10 5.10 x 5.10 5.10 x 5.10 5.10 +Document6 pagesا د م ا ا 0 ا x ا x ا S + 2 ل ' ةد ا ت آ م ا 0 5.10 5.10 x 5.10 5.10 x 5.10 5.10 +Ayoub ImgirneNo ratings yet