Professional Documents
Culture Documents
الموضوع الثاني..
الموضوع الثاني..
Uploaded by
Bedani DjilaliCopyright:
Available Formats
You might also like
- التحولات الكيميائية في المنحيينDocument1 pageالتحولات الكيميائية في المنحيينChikov ÆmineNo ratings yet
- التحولات الكيميائية في المنحيينDocument1 pageالتحولات الكيميائية في المنحيينAmine AlaoUii AlaouiNo ratings yet
- PC SC MathDocument8 pagesPC SC Mathالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- وحدة 4 سلسلة نهائيةDocument2 pagesوحدة 4 سلسلة نهائيةHassouNo ratings yet
- تمارين تطبيقية للتفاعلات الحمضية القاعديةDocument1 pageتمارين تطبيقية للتفاعلات الحمضية القاعديةfalkosatNo ratings yet
- Benzoic AcidDocument8 pagesBenzoic AcidIN BOLD بالخط العريضNo ratings yet
- فرض محروس رقم 3 الثانية علوم رياضية 2018Document5 pagesفرض محروس رقم 3 الثانية علوم رياضية 2018Abdelhak SadikNo ratings yet
- سلسلة تمارين 01Document3 pagesسلسلة تمارين 01Hachemane ImadeddineNo ratings yet
- Dzexams 2as Physique 293950Document7 pagesDzexams 2as Physique 293950Chioukh MusNo ratings yet
- تمارين وحلول في الكيمياءDocument3 pagesتمارين وحلول في الكيمياءالغزيزال الحسن EL GHZIZAL Hassane88% (17)
- الأعمال التطبيقيةDocument4 pagesالأعمال التطبيقيةaderbal.781No ratings yet
- Local Media1736541324Document18 pagesLocal Media1736541324benhamdiadil24No ratings yet
- Serie Chim 1Document2 pagesSerie Chim 1Ouarid NassiraNo ratings yet
- DPH DV: C H CoohDocument4 pagesDPH DV: C H Coohe.maskarNo ratings yet
- ExoU4 HAADocument4 pagesExoU4 HAAvbzrgNo ratings yet
- وثيقة المعايرة الـpH-متريّة (فارغة)Document2 pagesوثيقة المعايرة الـpH-متريّة (فارغة)emmmy1792No ratings yet
- 3 Ste 2012Document3 pages3 Ste 2012Soukrani AbdeljabbarNo ratings yet
- 6Document3 pages6e.maskarNo ratings yet
- محطة التقويم 4Document4 pagesمحطة التقويم 4Soufiane MlikuosNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2keomatNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2jackNo ratings yet
- Examens Nationaux 2bac Science Mathematiques PC 2017 RattrapageDocument20 pagesExamens Nationaux 2bac Science Mathematiques PC 2017 RattrapageFatima Larhmicذڤ1قhNo ratings yet
- 3Document7 pages3e.maskarNo ratings yet
- Wab Phy U4 ExDocument43 pagesWab Phy U4 Exwab.pro77No ratings yet
- Terminale 2eme Examen CorrectionDocument9 pagesTerminale 2eme Examen Correctionsalahbike3456No ratings yet
- Ssssssssssssssssssss SssDocument7 pagesSsssssssssssssssssss Sssyasserhayati06No ratings yet
- Bac 2010 SCDocument1 pageBac 2010 SCmehdibsbtNo ratings yet
- الامتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة العادية 2014 شعبة العلوم الرياضية أ و بDocument8 pagesالامتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة العادية 2014 شعبة العلوم الرياضية أ و بAyoub SetineNo ratings yet
- تمارين المعايرات المباشرة أولى باك النموذج 1 PDFDocument12 pagesتمارين المعايرات المباشرة أولى باك النموذج 1 PDFAyoub FatheNo ratings yet
- مراجعةDocument5 pagesمراجعةbouchireb smiaNo ratings yet
- Controle N° 2 2BSMDocument5 pagesControle N° 2 2BSMkhalid el yacoubiNo ratings yet
- 12Document4 pages12Assraoui SellamNo ratings yet
- موضوع في الكيمياءDocument1 pageموضوع في الكيمياءSheikh Al-shoteriNo ratings yet
- Sujets DEBILIDocument29 pagesSujets DEBILIسمير دبيليNo ratings yet
- Dzexams Docs 3as 904821Document2 pagesDzexams Docs 3as 904821ặděɱ ɱěžĥŏud-أدمہ مہزهودNo ratings yet
- PpppooDocument2 pagesPpppooImad Eddine sahraouiNo ratings yet
- 10 مقترحات-فيزياء سطيفDocument51 pages10 مقترحات-فيزياء سطيفmimokech2006No ratings yet
- Dzexams Docs 3as 904821Document3 pagesDzexams Docs 3as 904821wwaassiim2006No ratings yet
- Procedes 2mt20 1trim6Document2 pagesProcedes 2mt20 1trim6مولودNo ratings yet
- 3- التحولات المقرونة بالتفاعلات حمض - قاعدة في محلول مائيDocument17 pages3- التحولات المقرونة بالتفاعلات حمض - قاعدة في محلول مائيالغزيزال الحسن EL GHZIZAL Hassane50% (2)
- Exo Acide Base Faible CinetiqueDocument2 pagesExo Acide Base Faible CinetiqueIhsan Mokhlisse100% (1)
- Examens Nationaux 2bac Science PC 2015 RattrapageDocument14 pagesExamens Nationaux 2bac Science PC 2015 Rattrapagebadia ben abdellahNo ratings yet
- Exercices de ClasseDocument2 pagesExercices de ClassekeomatNo ratings yet
- Alfiziaa Oalkimiaa Alom Fiziaiia 2020 Aldora Alaadia AlmodhoaDocument7 pagesAlfiziaa Oalkimiaa Alom Fiziaiia 2020 Aldora Alaadia AlmodhoaUb AyoNo ratings yet
- Exc8 1bac PDFDocument3 pagesExc8 1bac PDFMeriem ZAGRIRINo ratings yet
- تطور جمل كيميائية نحو التوازنDocument9 pagesتطور جمل كيميائية نحو التوازنmidi zenineNo ratings yet
- Eddirasa Com Bac Sci Physique 2016Document8 pagesEddirasa Com Bac Sci Physique 2016Salamou chounawaNo ratings yet
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- الإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةDocument6 pagesالإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةMohamedElKatarNo ratings yet
- 7امتحان تجريبي 2020Document5 pages7امتحان تجريبي 2020ihabkharrouba566No ratings yet
- التمرين6Document4 pagesالتمرين6foud18No ratings yet
- التحولات الكيميائية التي تحدث في المنحيينDocument3 pagesالتحولات الكيميائية التي تحدث في المنحيينOmar ait taleb aliNo ratings yet
- المراجعة رق2Document4 pagesالمراجعة رق2Meli RtaNo ratings yet
الموضوع الثاني..
الموضوع الثاني..
Uploaded by
Bedani DjilaliCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
الموضوع الثاني..
الموضوع الثاني..
Uploaded by
Bedani DjilaliCopyright:
Available Formats
2022-2021 األستاذ : الموضوع الثاني للمراجعة
التمرين األول ------------------------------------------------------------- :
بعض التحوالت الكيميائية تكون تامة وبعضها غير تامة ،يستعمل الكيميائي عدة طرق لمتابعة هذه التحوالت زمنيا والتحكم فيها وذلك
من أجل رفع مردودها أو تخفيض سرعتها للحد من تأثيرها .يهدف هذا التمرين إلى دراسة بعض التحوالت غير التامة.
دراسة حمض البنزويك مع الماء : -I
حمض البنزويك C6 H 5COOHهو جسم صلب أبيض ضعيف االنحالل في الماء ،يستعمل كمادة حافظة في الصناعات الغذائية.
المعطيات :
-عند ، 25Cالناقليات النوعية المولية للشواردH O 35mS m2 mol 1 ، C H COO 3,2mS m mol :
2 1
3 6 5
-الكتلة المولية الجزيئية لحمض البنزويك . M (C6 H 5COOH ) 122 g :
حل كمية من البنزويك النقي كتلتها mفي الماء المقطر ،فنتحصل على محلول ) ( S1تركيزه المولي ca 102 mol / L
ن ّ
. Va وحجمه 500mL
.1اشرح البروتوكول التجريبي لتحضير هذا المحلول.
.2اكتب معادلة تفاعل حمض البنزويك مع الماء.
فوجدناه . 3,1 .3عند التوازن ،قسنا pHالمحلول ) (S1
ّبين أن حمض البنزويك هو حمض ضعيف. .1.3
1
للمحلول ) . ( S1 بتطبيق قانون كولروش ،احسب الناقلية النوعية
.2.3
مدد المحلول ) 10 ( S1مرات ،فنتحصل على محلول ) ( S2له pH 2 pH1وله ناقليته النوعية . 2 .4ن ّ
-اختر الجواب الصحيح مع التعليل 2 1 :أو . 2 1
مدرجة محلوال مائيا لهيدروكسيد الصوديوم .5أخذنا حجما V 20mLمن المحلول ) ، ( S2وأضفنا له تدريجيا من سحاحة ّ
[C6 H 5COOH ]
. log نسجل قيمة الـ pHعند إضافة كل إضافة ونمثّل بيانيا ) f ( pH
) ، ( Na OHحيث ّ
[C6 H 5COO ]
[C6 H 5COOH ]
log بداللة الـ . pH
عبر عن النسبة
ّ .1.5
6 5
[C H COO ]
اكتب معادلة تفاعل المعايرة. .2.5
حدد قيمة pKaللثنائية ) (C6 H5COOH / C6 H5COO
.1.5اعتمادا على البيانّ ،
كانت قيمة pHالمزيج .4.5علما أنه عند إضافة حجما قدره Vb 10mL
𝐻𝑝 ، 4, 2احسب التركيز المولي للمحلول الحمضي ) . ( S2
0
𝟒 𝟓 𝟔
احسب نسبة التقدم النهائي f 2لتفاعل الحمض مع الماء قبل بدء .5.5
−1
المعايرة.
حدد الصفة الغالبة للثنائية ) (C6 H5COOH / C6 H 5COOلما .6.5
ّ
. pH 7,4
لمدة ساعة مزيجا يتشكل من V 40mLمن إيثانوات
نسخن باالرتداد ّ
نقوم بعملية إماهة استر إيثانوات البنتيل ،حيث ّ -II
المركز.
البنتيل وحجم V ' 50mLمن الماء ،وبعض قطرات من حمض الكبريت ّ
بعد التبريد قمنا بمعالجة المزيج بواسطة هيدروجين كربونات الصوديوم من أجل إزالة الحمض منه ،وبعد التجفيف والتقطير تحصلنا
. m 13,6 g على كمية من الكحول كتلتها
الصيغ نصف المفصلة لكل من :إيثانوات البنتيل ،والحمض والكحول الناتجين في هذا التفاعل مع التسمية النظامية.
ّ .1اكتب
سمه.
.2إن أحد مماكبات هذا الكحول هو كحول ثالثي ،اكتب صيغته نصف المفصلة ثم ّ
.3اكتب معادلة التفاعل باستعمال الصيغ نصف المفصلة ،واذكر خصائص هذا التفاعل.
موضحا عليه البيانات الكافية.
.4ارسم شكال تخطيطيا للتجهيز المستعمل في التسخين باالرتداد ّ
ما الفائدة من التسخين بهذه الطريقة؟
.5احسب كمية المادة االبتدائية للمتفاعالت ثم أنشئ جدول تقدم التفاعل.
.6احسب مردود التفاعل ثم قارنه مع نفس قيمة المردود لمزيج متساوي الموالت لنفس التفاعل وماذا تستنتج.
من حمض اإليثانويك، مزجنا عند اللحظة t 0كمية كتلتها 8,8gمن أحد مماكبات الكحول السابق مع كتلة mA -III
بسدها ووضعناها في حمام مائي درجة ح اررته ثابتة.
وقسمنا المزيج بالتساوي في 10أنابيب ،وقمنا ّ
ّ
وبردناه ،وعايرنا الحمض الموجود فيه بواسطة محلول لهيدروكسيد الصوديومفي اللحظة tأخرجنا أنبوبا من الحمام المائي ّ
كررنا العملية مع األنابيب األخرى ومثلنا بيانيا كمية مادة الحمض في األنابيب بداللة الزمن.
) ّ . ( Na OH
.1لماذا ّبردنا المزيج؟
)𝑙𝑜𝑚𝑚(𝑛
. mA .2باالعتماد على البيان ،احسب قيمة الكتلة
50 .3اكتب معادلة التفاعل األسترة باستعمال صيغة الكحول
واذكر خصائص هذا التفاعل. Cn H 2n1 OH
ّ .4بين أن مردود التفاعل . r 13%
.5احسب ثابت التوازن للتفاعل الحادث.
48,7
نحدد المردود بحساب كتلة االستر الناتج في المزيج.
.6يمكن أن ّ
48 كيف يتم ذلك؟
0 2 )𝑡(ℎ .7اذكر كل الطرق الممكنة لتحسين مردود التفاعل.
المعطيات :
الماء إيثانوات البنتيل البنتانول 1 حمض اإليثانويك المركب
18g / mol 130 g / mol 88g / mol 60 g / mol الكتلة المولية
1g / mL 0,87 g / mL 0,81g / mL 1,05g / mL الكتلة الحجمية
التمرين الثاني------------------------------------------------------------------ :
تُستعمل المنضدة الهوائية إلجراء تجارب الميكانيك في غياب االحتكاكات.
يهدف هذا التمرين إلى دراسة حركة جسم صلب على مستو مائل ومدى تأثير بعض مميزات الحركة.
لهذا الغرض ،ننجز التجربتين التاليتين:
التجربة األولى :ن ّشغل فيها المضخة الهوائية بحيث يصبح االحتكاك على المنضدة معدوم.
عند اللحظة ، t 0ندفع جسم صلب ) ( Sنعتبره نقطة مادية كتلته m 100 gمن نقطة O
تمثل بداية مستوي مائل زاوية ميله ، بسرعة ابتدائية v 0حاملها موازي للمحور ) (Oxالدراسة
التجريبية لحركة الجسم أثناء صعوده ونزوله على طول المستوي المائل م ّكنت باستعمال برمجية
مناسبة من رسم البيان ) ( v f (tالشكل.)1-
)𝑠𝑣(𝑚/
الشكل1-
.1مثّل القوى المؤثرة على الجسم ) ( Sأثناء حركته.
0,8
.2ادرس طبيعة حركة الجسم ) ( Sفي كل مرحلة
0
𝟏 𝟎, (أثناء الصعود والنزول) مع التعليل.
)𝑠(𝑡
ّ .3بين أن زاوية الميل . 30
.4احسب المسافة المقطوعة للجسم خالل مرحلة الصعود.
التجربة الثانية :لم ن ّشغل المضخة بحيث نعتبر قوة االحتكاك على المنضدة ثابتة في الشدة fومعاكسة لجهة الحركة.
.1بتطبيق القانون الثاني لنيوتن في مرجع سطحي أرضي الذي نعتبره غاليليا:
-جد عبارة تسارع مركز عطالة الجسم ) ( Sخالل مرحلة الصعود بداللة . , f , g , m
.2بواسطة برمجية خاصة تم رسم البيان ) v g (tخالل مرحلة الصعود (الشكل.)2-
)𝑠𝑣(𝑚/
.1.2احسب شدة قوة االحتكاك . f
الشكل2-
.2.2احسب المسافة التي يقطعها الجسم خالل مرحلة الصعود وقارنها مع القيمة
0,8 المحسوبة في التجربة األولى .ماذا تستنتج.
مستعينا بعبارة تسارع مركز عطالة الجسم خالل مرحلة النزولّ ،بين أـن 3.2
0 )𝑠(𝑡
0,1
الجسم ) ( Sال يعود إلى النقطة ) (Oبنفس السرعة التي دفع بها.
.4.2استنتج لحظة وصوله إلى النقطة ). (O
.5.2أكمل مخطط السرعة ) v g (tحتى لحظة وصول الجسم إلى النقطة ). (O
يعطىg 10m / s 2 :
التمرين الثالث ----------------------------------------------------------------- :
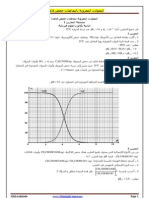
من أجل المتابعة الزمنية للتحول الكيميائي التام الحادث بين معدن الزنك ) Zn( sومحلول ثنائي اليود ) ( I 2( aqذو اللون البني)
نحضر محلول مائي S 0لثنائي اليود ) I 2( aqحجمه V ' 500mLوتركيزه
ّ عند درجة ح اررة ثابتة،
) 𝜎(𝑆. 𝑚−1 المولي ، c0ن ّقسم المزيج إلى جزأين متماثلين في كأسين بيشر.
الجزء :1عند اللحظة t 0نأخذ أحد الكأسين الذي حجمه Vونضيف له كمية
كافية من مسحوق الزنك النقي ) ، Zn( sنتابع زمنيا تطور هذا التحول عن طريق
الشكل1- للمحلول فتحصلنا على المنحنى الممثل في الشكل،1- قياس الناقلية النوعية
OHوشوارد الهيدرونيوم H 3O الناتجة عن (نهمل تأثير شوارد الهيدروكسيد
0,5 التفكك الذاتي للماء على ناقلية المزيج المتفاعل) .معادلة التفاعل الحادث هي:
) Zn( s ) I 2( aq ) Zn 2 ( aq ) 2 I ( aq
0 31 )𝑠(𝑡
حدد الثنائيتان ) (Ox / Re dالداخلتان في التفاعل.
ّ -1
-2اعتمادا على جدول تقدم التفاعل ّبين أن عبارة الناقلية النوعية ) (tللمزيج التفاعلي تُكتب بالعالقة ) ، (t ) A x(t
وتحديد قيمته. , حيث Aثابت ُيطلب تعيين عبارته بداللة الحجم Vو
I Zn2
حدد قيمة X maxثم استنتج قيمة c0التركيز المولي االبتدائي للمحلول . S 0
-3اعتمادا على البيانّ ،
عرف السرعة الحجمية للتفاعل ثم احسب قيمتها األعظمية.
ّ -4
Zn 2 ُيعطى 10,56mS.m2 .mol 1; I 7, 68mS.m2 .mol 1 :
)𝑔()𝑛𝑍(𝑚
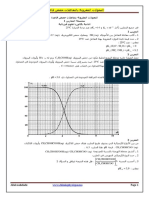
الشكل -2- نكرر نفس التجربة السابقة وذلك بغمر صفيحة من الزنك النقي
الجزء ّ :2
) Zn( sكتلتها m0في الكأس الثاني من المحلول السابق ، S 0
بواسطة تقنية خاصة تم ّكنا من رسم المنحنيين التاليين الممثلين في
الشكلين 2و.3
-1اعتمادا على المنحنيين ،اذكر بعض مميزات هذا التحول.
0,645
-2اعتمادا على جدول تقدم التفاعلّ ،بين أن:
0 20 )𝑠(𝑡 m0
nZn V [ I 2 ] C0V
)M ( Zn
-3اعتمادا على المنحنيين الممثّلين في الشكل 2و:3
)𝑙𝑜𝑚()𝑛𝑍(𝑛 أ -تأكد من قيمة التركيز المولي c0للمحلول . S 0
حدد زمن نصف التفاعل . t1/2
بّ -
1 dmZn
vvol -4بّين أن السرعة الحجمية للتفاعل تعطى بالعالقة التالية:
)V .M ( Zn dt
الشكل -3- ثم احسب قيمتها عند اللحظة . t 0
المعطياتM (Zn) 65,4 g / mol :
0,01
) [𝐼2 ](𝑚𝑜𝑙. 𝐿−1
0 0,05
You might also like
- التحولات الكيميائية في المنحيينDocument1 pageالتحولات الكيميائية في المنحيينChikov ÆmineNo ratings yet
- التحولات الكيميائية في المنحيينDocument1 pageالتحولات الكيميائية في المنحيينAmine AlaoUii AlaouiNo ratings yet
- PC SC MathDocument8 pagesPC SC Mathالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- وحدة 4 سلسلة نهائيةDocument2 pagesوحدة 4 سلسلة نهائيةHassouNo ratings yet
- تمارين تطبيقية للتفاعلات الحمضية القاعديةDocument1 pageتمارين تطبيقية للتفاعلات الحمضية القاعديةfalkosatNo ratings yet
- Benzoic AcidDocument8 pagesBenzoic AcidIN BOLD بالخط العريضNo ratings yet
- فرض محروس رقم 3 الثانية علوم رياضية 2018Document5 pagesفرض محروس رقم 3 الثانية علوم رياضية 2018Abdelhak SadikNo ratings yet
- سلسلة تمارين 01Document3 pagesسلسلة تمارين 01Hachemane ImadeddineNo ratings yet
- Dzexams 2as Physique 293950Document7 pagesDzexams 2as Physique 293950Chioukh MusNo ratings yet
- تمارين وحلول في الكيمياءDocument3 pagesتمارين وحلول في الكيمياءالغزيزال الحسن EL GHZIZAL Hassane88% (17)
- الأعمال التطبيقيةDocument4 pagesالأعمال التطبيقيةaderbal.781No ratings yet
- Local Media1736541324Document18 pagesLocal Media1736541324benhamdiadil24No ratings yet
- Serie Chim 1Document2 pagesSerie Chim 1Ouarid NassiraNo ratings yet
- DPH DV: C H CoohDocument4 pagesDPH DV: C H Coohe.maskarNo ratings yet
- ExoU4 HAADocument4 pagesExoU4 HAAvbzrgNo ratings yet
- وثيقة المعايرة الـpH-متريّة (فارغة)Document2 pagesوثيقة المعايرة الـpH-متريّة (فارغة)emmmy1792No ratings yet
- 3 Ste 2012Document3 pages3 Ste 2012Soukrani AbdeljabbarNo ratings yet
- 6Document3 pages6e.maskarNo ratings yet
- محطة التقويم 4Document4 pagesمحطة التقويم 4Soufiane MlikuosNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2keomatNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2jackNo ratings yet
- Examens Nationaux 2bac Science Mathematiques PC 2017 RattrapageDocument20 pagesExamens Nationaux 2bac Science Mathematiques PC 2017 RattrapageFatima Larhmicذڤ1قhNo ratings yet
- 3Document7 pages3e.maskarNo ratings yet
- Wab Phy U4 ExDocument43 pagesWab Phy U4 Exwab.pro77No ratings yet
- Terminale 2eme Examen CorrectionDocument9 pagesTerminale 2eme Examen Correctionsalahbike3456No ratings yet
- Ssssssssssssssssssss SssDocument7 pagesSsssssssssssssssssss Sssyasserhayati06No ratings yet
- Bac 2010 SCDocument1 pageBac 2010 SCmehdibsbtNo ratings yet
- الامتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة العادية 2014 شعبة العلوم الرياضية أ و بDocument8 pagesالامتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة العادية 2014 شعبة العلوم الرياضية أ و بAyoub SetineNo ratings yet
- تمارين المعايرات المباشرة أولى باك النموذج 1 PDFDocument12 pagesتمارين المعايرات المباشرة أولى باك النموذج 1 PDFAyoub FatheNo ratings yet
- مراجعةDocument5 pagesمراجعةbouchireb smiaNo ratings yet
- Controle N° 2 2BSMDocument5 pagesControle N° 2 2BSMkhalid el yacoubiNo ratings yet
- 12Document4 pages12Assraoui SellamNo ratings yet
- موضوع في الكيمياءDocument1 pageموضوع في الكيمياءSheikh Al-shoteriNo ratings yet
- Sujets DEBILIDocument29 pagesSujets DEBILIسمير دبيليNo ratings yet
- Dzexams Docs 3as 904821Document2 pagesDzexams Docs 3as 904821ặděɱ ɱěžĥŏud-أدمہ مہزهودNo ratings yet
- PpppooDocument2 pagesPpppooImad Eddine sahraouiNo ratings yet
- 10 مقترحات-فيزياء سطيفDocument51 pages10 مقترحات-فيزياء سطيفmimokech2006No ratings yet
- Dzexams Docs 3as 904821Document3 pagesDzexams Docs 3as 904821wwaassiim2006No ratings yet
- Procedes 2mt20 1trim6Document2 pagesProcedes 2mt20 1trim6مولودNo ratings yet
- 3- التحولات المقرونة بالتفاعلات حمض - قاعدة في محلول مائيDocument17 pages3- التحولات المقرونة بالتفاعلات حمض - قاعدة في محلول مائيالغزيزال الحسن EL GHZIZAL Hassane50% (2)
- Exo Acide Base Faible CinetiqueDocument2 pagesExo Acide Base Faible CinetiqueIhsan Mokhlisse100% (1)
- Examens Nationaux 2bac Science PC 2015 RattrapageDocument14 pagesExamens Nationaux 2bac Science PC 2015 Rattrapagebadia ben abdellahNo ratings yet
- Exercices de ClasseDocument2 pagesExercices de ClassekeomatNo ratings yet
- Alfiziaa Oalkimiaa Alom Fiziaiia 2020 Aldora Alaadia AlmodhoaDocument7 pagesAlfiziaa Oalkimiaa Alom Fiziaiia 2020 Aldora Alaadia AlmodhoaUb AyoNo ratings yet
- Exc8 1bac PDFDocument3 pagesExc8 1bac PDFMeriem ZAGRIRINo ratings yet
- تطور جمل كيميائية نحو التوازنDocument9 pagesتطور جمل كيميائية نحو التوازنmidi zenineNo ratings yet
- Eddirasa Com Bac Sci Physique 2016Document8 pagesEddirasa Com Bac Sci Physique 2016Salamou chounawaNo ratings yet
- _-_-_-_-_-_-_Document25 pages_-_-_-_-_-_-_آلاء الرحمن100% (2)
- الإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةDocument6 pagesالإمتحان الوطني للبكالوريا مادة الفيزياء والكيمياء الدورة الاستدراكية 2015 شعبة العلوم التجريبية مسلك العلوم الفيزيائيةMohamedElKatarNo ratings yet
- 7امتحان تجريبي 2020Document5 pages7امتحان تجريبي 2020ihabkharrouba566No ratings yet
- التمرين6Document4 pagesالتمرين6foud18No ratings yet
- التحولات الكيميائية التي تحدث في المنحيينDocument3 pagesالتحولات الكيميائية التي تحدث في المنحيينOmar ait taleb aliNo ratings yet
- المراجعة رق2Document4 pagesالمراجعة رق2Meli RtaNo ratings yet