Professional Documents
Culture Documents
Kyselost A Zasaditost
Kyselost A Zasaditost
Uploaded by
Miriam TomanovaCopyright:
Available Formats
You might also like
- Laboratorní Práce Z Chemie Žabenský Ivo G1.BDocument66 pagesLaboratorní Práce Z Chemie Žabenský Ivo G1.BhonzachabadaNo ratings yet
- Zajímavé Chemické PokusyDocument58 pagesZajímavé Chemické PokusyMartin ŠmatlákNo ratings yet
- Ales Stromek - NeutralizaceDocument4 pagesAles Stromek - Neutralizaceluk.krafNo ratings yet
- Pokusy PDFDocument34 pagesPokusy PDFmichNo ratings yet
- Soli ZástupciDocument2 pagesSoli Zástupcilenka.kvasnicovaNo ratings yet
- 18 CHS5MZ2Document13 pages18 CHS5MZ2gtape06No ratings yet
- 007 - LCv-pracovni List-Mereni PHDocument2 pages007 - LCv-pracovni List-Mereni PHFrantaNo ratings yet
- Protokol Z Laboratorního Cvičení Č.: Jméno A Příjmení: Aleš Šrámek Třída: S4.A Název Úlohy: Datum KonáníDocument6 pagesProtokol Z Laboratorního Cvičení Č.: Jméno A Příjmení: Aleš Šrámek Třída: S4.A Název Úlohy: Datum Konáníluk.krafNo ratings yet
- Sila Kyselin A Zasad 2021Document6 pagesSila Kyselin A Zasad 2021Petr JánskýNo ratings yet
- ArticleDocument5 pagesArticlekarelknoplolNo ratings yet
- PH NovyDocument1 pagePH NovyPoli PopováNo ratings yet
- Krafka - NeutralizaceDocument5 pagesKrafka - Neutralizaceluk.krafNo ratings yet
- LabTech - Protokol Analýza Čistoty SkaliceDocument2 pagesLabTech - Protokol Analýza Čistoty SkalicePavel ValentaNo ratings yet
- Kyselost A Zasaditost Roztoku ReseniDocument2 pagesKyselost A Zasaditost Roztoku ReseniDavid FriedlNo ratings yet
- Acc Chelatometrie 2022Document4 pagesAcc Chelatometrie 2022davidorgonikNo ratings yet
- Odbarvení KečupuDocument2 pagesOdbarvení KečupuZaneta KorchanovaNo ratings yet
- Sacharidy A Vitam N CDocument3 pagesSacharidy A Vitam N CEmma OndováNo ratings yet
- Acc-Manganometrie - Jodometrie - 2022Document9 pagesAcc-Manganometrie - Jodometrie - 2022Matvij DrulNo ratings yet
- Velich Vít Α-Hořké KyselinyDocument11 pagesVelich Vít Α-Hořké Kyselinylambada.tipsNo ratings yet
- Protokol cv1Document5 pagesProtokol cv1Honza MartinekNo ratings yet
- Autorske Reseni 2022Document72 pagesAutorske Reseni 2022simonmach2006No ratings yet
- Hydroxyderiváty A KarbonylyDocument92 pagesHydroxyderiváty A KarbonylyVladimirNo ratings yet
- Acc Acidobazicke TitraceDocument5 pagesAcc Acidobazicke TitraceMatvij DrulNo ratings yet
- Tajné Inkousty. Secret Inks.Document27 pagesTajné Inkousty. Secret Inks.VítězslavČermák0% (1)
- Kyseliny A Zásady - PLDocument6 pagesKyseliny A Zásady - PLukra1nian boyNo ratings yet
- Protokol 1Document2 pagesProtokol 1Jakub ProcházkaNo ratings yet
- p3 PrvkyDocument7 pagesp3 Prvkylenka.kvasnicovaNo ratings yet
- VY 32 INOVACE Ch.02.13Document10 pagesVY 32 INOVACE Ch.02.13Summer's boobsNo ratings yet
- Tungsten Complex and Redox ChemistryDocument28 pagesTungsten Complex and Redox ChemistryLaChaine DudéveloppeurNo ratings yet
- Laboratorní Protokol Z Chemie 2Document3 pagesLaboratorní Protokol Z Chemie 2Karolína OndrováNo ratings yet
- 88 81 Klic Ke Cvicenim Z Ps Chemie 8Document30 pages88 81 Klic Ke Cvicenim Z Ps Chemie 8Jan HerinkNo ratings yet
- Domácí Pokus PHDocument2 pagesDomácí Pokus PHVendula PáčováNo ratings yet
- Vonné A Chuťové Složky Sladů: Arel EjpekDocument10 pagesVonné A Chuťové Složky Sladů: Arel EjpekAlanClaveroRiquelmeNo ratings yet
- Labtechna Final BacDocument30 pagesLabtechna Final BacJan BartoňNo ratings yet
- Roztok, Protolytické ReakceDocument4 pagesRoztok, Protolytické ReakceelizdrazNo ratings yet
- Soli - Pracovni ListDocument6 pagesSoli - Pracovni Listdankos.xdNo ratings yet
- Zaverecna PraceDocument68 pagesZaverecna PraceoldavachalaNo ratings yet
- Karboxylové Kyseliny A Ich DerivátyDocument21 pagesKarboxylové Kyseliny A Ich Derivátyzerzig11No ratings yet
- CHEMIE - Karboxylové Kyseliny - Středoškolské VýpiskyDocument5 pagesCHEMIE - Karboxylové Kyseliny - Středoškolské VýpiskyAdriana PotužníkováNo ratings yet
- Hydroxy de Riva TyDocument50 pagesHydroxy de Riva TyKristýna VondráčkováNo ratings yet
- Příprava Dihydrátu Síranu VápenatéhoDocument1 pagePříprava Dihydrátu Síranu VápenatéhoViktorie KovářováNo ratings yet
- 13a Derivaty Kyseliny UhliciteDocument24 pages13a Derivaty Kyseliny UhliciteJan SormanNo ratings yet
- Kyseliny Zasady 2023-1Document39 pagesKyseliny Zasady 2023-1reaktikusNo ratings yet
- Chemikem Doma 9 - Indikátor Ze Zelí - Pracovní Návod + Pracovní ListDocument5 pagesChemikem Doma 9 - Indikátor Ze Zelí - Pracovní Návod + Pracovní ListAnna BeranováNo ratings yet
- HydroxyderivátyDocument24 pagesHydroxyderivátyVladimirNo ratings yet
- 1 - Patinovani Medi II - NavodyDocument2 pages1 - Patinovani Medi II - NavodyViera ValachováNo ratings yet
- Acidobazické ReakceDocument8 pagesAcidobazické ReakceKarolína KurfürstováNo ratings yet
- 17 - Alkoholy, Fen., Alde., Ket., Ethe.Document6 pages17 - Alkoholy, Fen., Alde., Ket., Ethe.Zuzana ŠuráňováNo ratings yet
- Rlo 6 - PetDocument3 pagesRlo 6 - PetPETR SMITHNo ratings yet
- Otevřít MAP - 2.NSDocument31 pagesOtevřít MAP - 2.NSdkhekovaNo ratings yet
- LABORATORNÍ PRÁCE PHDocument3 pagesLABORATORNÍ PRÁCE PHtriskaraimundNo ratings yet
- ChPrima 24 Kys Kys 2022Document2 pagesChPrima 24 Kys Kys 2022Nicolas Mário SedlářNo ratings yet
- Otázky Karbonylové SloučeninyDocument6 pagesOtázky Karbonylové SloučeninyTerezka MerinskaNo ratings yet
- Screenshot 2022-12-05 at 7.31.47Document8 pagesScreenshot 2022-12-05 at 7.31.47c98mp6yzv4No ratings yet
- Analytická Chemie - ZkouškaDocument47 pagesAnalytická Chemie - ZkouškaRenata ŽdímalováNo ratings yet
- 60 C SK Praxe ZadaniDocument6 pages60 C SK Praxe Zadanipatrik.jandik7No ratings yet
- PL - IndirátoryDocument11 pagesPL - Indirátorybqgsjckv2rNo ratings yet
- Lab. Cvičení 8Document3 pagesLab. Cvičení 8patrik.jandik7No ratings yet
- Picovina 1Document4 pagesPicovina 14qvxvnsvjmNo ratings yet
Kyselost A Zasaditost
Kyselost A Zasaditost
Uploaded by
Miriam TomanovaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Kyselost A Zasaditost
Kyselost A Zasaditost
Uploaded by
Miriam TomanovaCopyright:
Available Formats
Miriam Tomanoval
Jméno: __________________________
4 Datum, třída: __________________________
7 11 2 A
.
., .
Laboratorní práce č. /
3
Téma: Acidobazické reakce
Úkol č. 1: Kyselost a zásaditost roztoků
Chemikálie: acidobazické indikátory, HCl, CH3COOH, H2O, Na2CO3, KOH
Pomůcky: zkumavky, stojan na zkumavky, kapátko, pH papírky
Postup:
1. Do 3 zkumavek nalijte roztok HCl.
2. Tento roztok změřte pomocí pH papírku a zaznamenejte hodnotu pH do tabulky.
3. Přidejte do každé zkumavky jiný indikátor a barevné změny zaznamenejte do tabulky.
4. Stejný postup zopakujte u všech látek.
5. Podle tabulky vyhodnoťte jaké barevné změny nastávají u jednotlivých indikátorů v kyselém a zásaditém prostředí.
Pozorování:
Roztok/indikátor pH papírky methyloranž fenolftalein výluh - červené zelí
HCl kysele-rizorel kysel-cervena kysele-bezbarre ruZone kysele
·
-
CH3COOH do Tervenakysele-bezbarre nizore-kysele
kysele-oranzonel kysele-oraniorà
H2O neutralni-zelenal
↑
neutralni-oranioual kysele-bezbarre slabékysele fialove
-
Na2CO3
zasaditost-modra zisadità-oranzoral zásadité-nizoro-fialore zasadite-zelene
KOH zasaditist-modra zásadità-oranzora- zasadité -nizovo-cerrene zasadité-iluto-zelene
Otázky:
1. Co je to acidobazický indikátor? Jaké indikátory znáte? látke , co mani barra podle kyselosti, meso masaditost , prostred
2. Jaké znáte teorie kyselin a zásad? Jak je podle nich definována kyselina a zásada?
. indicatory pH papirly methylorans tenolftalein privdni indicatory
1 :
, , ,
.
2 teorie
Assheiniova
-
kyselina
= Le roduém 04 Koncentrad He
zisada=↑ koncentrace Of ve roduim D
Bronstedova-Loweryho forse
-
kyselina=schopna darovat/odstipit H+
zásada=schopna prijmoct Ht
Úkol č. 2: Experimenty s výluhem z červeného zelí
Chemikálie: výluh z červeného zelí, mléko, jedlá soda, ocet, minerální voda, mýdlová voda, krtek
Pomůcky: zkumavky, stojan na zkumavky, kapátko
Postup:
1. Do 6 zkumavek nalijte jednotlivé roztoky (1/3).
2. Postupně přikápněte k roztokům výluh z červeného zelí.
3. Podle zbarvení roztoků a pozorování u úkolu č.2 rozhodněte, zda byl daný roztok spíše kyselý či zásaditý.
Pozorování:
Roztok hypotéza výluh č. z. - zbarvení zásaditý/kyselý
mléko zásadi te Galora k
jedlá soda kysele tyrkysova 2
ocet kysele joval
niz K
mýdlová voda zásadite tyrkysoval 2
pivo kysele niovo-fialora K
minerální voda zásaditel fialora K
Savo kysele Elutal Z
Rozmezí pH 0-3 4-6 7-8 9-12 12-14
Zbarvení červená fialová modrá zelená žlutá
Otázky:
1. Jaké přírodní látky obsažené v červeném zelí jsou zodpovědné za změnu zbarvení?
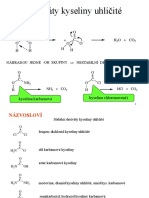
Úkol č. 3: Hydrolýza solí
Teorie: Hydrolýza solí je acidobazická reakce, při které ionty soli reagují s vodou za vzniku iontů hydroxidových (OH-), nebo
oxoniových (H3O+). Tím se změní hodnota pH vzniklého roztoku. Celý děj je možno rozdělit na dvě fáze:
a) rozpouštění krystalů soli ve vodě, při kterém dochází k rozrušování iontové struktury soli a k uvolňování
iontů (disociace soli)
b) vlastní acidobazická reakce iontů soli s vodou
Chemikálie: NaCl, Na2CO3, FeCl3
Pomůcky: 3 kádinky, skleněná tyčinka, pH papírky
Postup:
1. Pomocí skleněných tyčinek přeneste kapku jednotlivých roztoků na pH papírek.
2. Porovnáním se stupnicí na obalu určete pH jednotlivých roztoků.
Pozorování:
Otázky:
1. Co je to hydrolýza?
2. Zdůvodněte zjištěné hodnoty pH připravených roztoků solí.
Závěr: (Žáci zhodnotí svůj výsledek práce. Zda potvrdili svoje hypotézy, zda je něco překvapilo. Dále napíší, zda se
jim něco nepovedlo a jak by se dalo případným chybám předejít.)
You might also like
- Laboratorní Práce Z Chemie Žabenský Ivo G1.BDocument66 pagesLaboratorní Práce Z Chemie Žabenský Ivo G1.BhonzachabadaNo ratings yet
- Zajímavé Chemické PokusyDocument58 pagesZajímavé Chemické PokusyMartin ŠmatlákNo ratings yet
- Ales Stromek - NeutralizaceDocument4 pagesAles Stromek - Neutralizaceluk.krafNo ratings yet
- Pokusy PDFDocument34 pagesPokusy PDFmichNo ratings yet
- Soli ZástupciDocument2 pagesSoli Zástupcilenka.kvasnicovaNo ratings yet
- 18 CHS5MZ2Document13 pages18 CHS5MZ2gtape06No ratings yet
- 007 - LCv-pracovni List-Mereni PHDocument2 pages007 - LCv-pracovni List-Mereni PHFrantaNo ratings yet
- Protokol Z Laboratorního Cvičení Č.: Jméno A Příjmení: Aleš Šrámek Třída: S4.A Název Úlohy: Datum KonáníDocument6 pagesProtokol Z Laboratorního Cvičení Č.: Jméno A Příjmení: Aleš Šrámek Třída: S4.A Název Úlohy: Datum Konáníluk.krafNo ratings yet
- Sila Kyselin A Zasad 2021Document6 pagesSila Kyselin A Zasad 2021Petr JánskýNo ratings yet
- ArticleDocument5 pagesArticlekarelknoplolNo ratings yet
- PH NovyDocument1 pagePH NovyPoli PopováNo ratings yet
- Krafka - NeutralizaceDocument5 pagesKrafka - Neutralizaceluk.krafNo ratings yet
- LabTech - Protokol Analýza Čistoty SkaliceDocument2 pagesLabTech - Protokol Analýza Čistoty SkalicePavel ValentaNo ratings yet
- Kyselost A Zasaditost Roztoku ReseniDocument2 pagesKyselost A Zasaditost Roztoku ReseniDavid FriedlNo ratings yet
- Acc Chelatometrie 2022Document4 pagesAcc Chelatometrie 2022davidorgonikNo ratings yet
- Odbarvení KečupuDocument2 pagesOdbarvení KečupuZaneta KorchanovaNo ratings yet
- Sacharidy A Vitam N CDocument3 pagesSacharidy A Vitam N CEmma OndováNo ratings yet
- Acc-Manganometrie - Jodometrie - 2022Document9 pagesAcc-Manganometrie - Jodometrie - 2022Matvij DrulNo ratings yet
- Velich Vít Α-Hořké KyselinyDocument11 pagesVelich Vít Α-Hořké Kyselinylambada.tipsNo ratings yet
- Protokol cv1Document5 pagesProtokol cv1Honza MartinekNo ratings yet
- Autorske Reseni 2022Document72 pagesAutorske Reseni 2022simonmach2006No ratings yet
- Hydroxyderiváty A KarbonylyDocument92 pagesHydroxyderiváty A KarbonylyVladimirNo ratings yet
- Acc Acidobazicke TitraceDocument5 pagesAcc Acidobazicke TitraceMatvij DrulNo ratings yet
- Tajné Inkousty. Secret Inks.Document27 pagesTajné Inkousty. Secret Inks.VítězslavČermák0% (1)
- Kyseliny A Zásady - PLDocument6 pagesKyseliny A Zásady - PLukra1nian boyNo ratings yet
- Protokol 1Document2 pagesProtokol 1Jakub ProcházkaNo ratings yet
- p3 PrvkyDocument7 pagesp3 Prvkylenka.kvasnicovaNo ratings yet
- VY 32 INOVACE Ch.02.13Document10 pagesVY 32 INOVACE Ch.02.13Summer's boobsNo ratings yet
- Tungsten Complex and Redox ChemistryDocument28 pagesTungsten Complex and Redox ChemistryLaChaine DudéveloppeurNo ratings yet
- Laboratorní Protokol Z Chemie 2Document3 pagesLaboratorní Protokol Z Chemie 2Karolína OndrováNo ratings yet
- 88 81 Klic Ke Cvicenim Z Ps Chemie 8Document30 pages88 81 Klic Ke Cvicenim Z Ps Chemie 8Jan HerinkNo ratings yet
- Domácí Pokus PHDocument2 pagesDomácí Pokus PHVendula PáčováNo ratings yet
- Vonné A Chuťové Složky Sladů: Arel EjpekDocument10 pagesVonné A Chuťové Složky Sladů: Arel EjpekAlanClaveroRiquelmeNo ratings yet
- Labtechna Final BacDocument30 pagesLabtechna Final BacJan BartoňNo ratings yet
- Roztok, Protolytické ReakceDocument4 pagesRoztok, Protolytické ReakceelizdrazNo ratings yet
- Soli - Pracovni ListDocument6 pagesSoli - Pracovni Listdankos.xdNo ratings yet
- Zaverecna PraceDocument68 pagesZaverecna PraceoldavachalaNo ratings yet
- Karboxylové Kyseliny A Ich DerivátyDocument21 pagesKarboxylové Kyseliny A Ich Derivátyzerzig11No ratings yet
- CHEMIE - Karboxylové Kyseliny - Středoškolské VýpiskyDocument5 pagesCHEMIE - Karboxylové Kyseliny - Středoškolské VýpiskyAdriana PotužníkováNo ratings yet
- Hydroxy de Riva TyDocument50 pagesHydroxy de Riva TyKristýna VondráčkováNo ratings yet
- Příprava Dihydrátu Síranu VápenatéhoDocument1 pagePříprava Dihydrátu Síranu VápenatéhoViktorie KovářováNo ratings yet
- 13a Derivaty Kyseliny UhliciteDocument24 pages13a Derivaty Kyseliny UhliciteJan SormanNo ratings yet
- Kyseliny Zasady 2023-1Document39 pagesKyseliny Zasady 2023-1reaktikusNo ratings yet
- Chemikem Doma 9 - Indikátor Ze Zelí - Pracovní Návod + Pracovní ListDocument5 pagesChemikem Doma 9 - Indikátor Ze Zelí - Pracovní Návod + Pracovní ListAnna BeranováNo ratings yet
- HydroxyderivátyDocument24 pagesHydroxyderivátyVladimirNo ratings yet
- 1 - Patinovani Medi II - NavodyDocument2 pages1 - Patinovani Medi II - NavodyViera ValachováNo ratings yet
- Acidobazické ReakceDocument8 pagesAcidobazické ReakceKarolína KurfürstováNo ratings yet
- 17 - Alkoholy, Fen., Alde., Ket., Ethe.Document6 pages17 - Alkoholy, Fen., Alde., Ket., Ethe.Zuzana ŠuráňováNo ratings yet
- Rlo 6 - PetDocument3 pagesRlo 6 - PetPETR SMITHNo ratings yet
- Otevřít MAP - 2.NSDocument31 pagesOtevřít MAP - 2.NSdkhekovaNo ratings yet
- LABORATORNÍ PRÁCE PHDocument3 pagesLABORATORNÍ PRÁCE PHtriskaraimundNo ratings yet
- ChPrima 24 Kys Kys 2022Document2 pagesChPrima 24 Kys Kys 2022Nicolas Mário SedlářNo ratings yet
- Otázky Karbonylové SloučeninyDocument6 pagesOtázky Karbonylové SloučeninyTerezka MerinskaNo ratings yet
- Screenshot 2022-12-05 at 7.31.47Document8 pagesScreenshot 2022-12-05 at 7.31.47c98mp6yzv4No ratings yet
- Analytická Chemie - ZkouškaDocument47 pagesAnalytická Chemie - ZkouškaRenata ŽdímalováNo ratings yet
- 60 C SK Praxe ZadaniDocument6 pages60 C SK Praxe Zadanipatrik.jandik7No ratings yet
- PL - IndirátoryDocument11 pagesPL - Indirátorybqgsjckv2rNo ratings yet
- Lab. Cvičení 8Document3 pagesLab. Cvičení 8patrik.jandik7No ratings yet
- Picovina 1Document4 pagesPicovina 14qvxvnsvjmNo ratings yet