Professional Documents
Culture Documents
Adenozin Trifoszfát
Adenozin Trifoszfát
Uploaded by
eszter09tothOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Adenozin Trifoszfát
Adenozin Trifoszfát
Uploaded by
eszter09tothCopyright:
Available Formats
ÁRDOS GYÖRGY– SARKADI BALÁZS
Az ATP – az élet tüzelôanyaga
Az 1997-es kémiai Nobel-díjat három kutató nyerte el: a díj 50%-át az Aarhusi
Egyetem 79 éves professzora, a dán Jens C. Skou kapta az ATP energiáját
felhasználó nátrium-kálium aktivált ATP-áz (Na+,K+-ATP-áz) felfedezéséért, míg a
díj másik felét megosztva nyerte el az amerikai Paul D. Boyer és az angol John E.
Walker, az ATP-képzôdés mechanizmusának feltárásáért. Paul Boyer (szintén 79
éves) a Los Angeles-i Egyetem (UCLA) nyugalmazott professzora, míg az 54 éves
John Walker a cambridge-i orvosi kutatóközpont molekuláris biológiai
laboratóriumának kutatója. Mindhárom díjazott országa tudományos
akadémiájának tagja, már eddig is számos tudományos díjnak és kitüntetésnek
tulajdonosa. Az, hogy 1997-ben éppen ôk nyerték el a nagy presztízsû Nobel-díjat,
egyben azt is jelzi, hogy az életfolyamatok alapjainak megismerésében az ATP
szerepének kutatása újabb felvirágzását éli.
Jens C. Skou John E. Walker Paul D. Boyer
Az ATP, a sejtek központi energiaforrása
Az adenozin-trifoszfátot, vagy közhasználatú rövidítésben az ATP-t, a német Karl
Lohmann fedezte fel 1929-ben, majd a pontos kémiai szerkezet tisztázása után
1948-ban a skót Alexander Todd (Nobel-díjat kapott 1957-ben) állította elô
mesterségesen. Azt, hogy ez a molekula az élô sejtek legfontosabb energiaforrása
és egy ún. magas-energiájú foszfátkötést tartalmaz, Fritz Lippmann, az 1953-ban
Nobel-díjjal kitûntetett tudós bizonyította. A baktériumoktól a gombákon és
növényeken keresztül az emberig az ATP-molekula a táplálékból származó energia
legfôbb raktározója, ill. szolgáltatója az életfolyamatok számára.
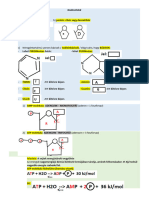
Az ATP egy adenozin-molekulából és a hozzá
kapcsolódó három foszfátcsoportból épül fel (1.
ábra). A legutolsó foszfátcsoport leválasztása
során két foszfátcsoportot tartalmazó vegyület
keletkezik, az adenozin-difoszfát (ADP). A
foszfátcsoport lehasításakor igen nagy energia
szabadul fel, amelyet a sejt kémiai folyamatainak
sokasága képes felhasználni. Az ATP-nek
az ADP-bôl való képzéséhez ugyanígy nagy
energiabefektetés szükséges, amelyet a sejtekben
a cukrok és egyéb tápanyagok lebontása,
elsôsorban oxidációja biztosít. Mindez az ATP-
képzôdési és -lebontási folyamat állandóan és
nagy sebességgel folyik a szervezetünkben: a
naponta képzôdô ATP mennyisége az emberi
testben nyugalmi állapotban is 30–40
kilogramm, izommunka esetén azonban akár egy
tonnányira is felmehet. Természetesen ez nem
egy tonnányi új anyag képzôdését, hanem
1. ábra. Az adenozin-trifoszfát (ATP) az ATP folyamatos szintézisét és lebontását
és az adenozin-difoszfát (ADP)
jelenti.
kémiai szerkezete. A vegyületek
a sejten belül Mg2+-ionokkal
alkotnak komplexet.
Az elsôként felfedezett molekuláris pumpa
Századunk huszas-harmincas éveiben vált világossá, hogy az élô sejteken belül az
ionösszetétel jelentôsen különbözik a sejteket körülvevô vérplazma vagy szöveti
folyadék összetételétôl. A sejten belüli magas kálium-, ill. alacsony
nátriumkoncentrációra az elsô magyarázat a sejthártya "átjárhatatlansága" volt e
kationokra nézve. Az 1940-es években azonban a magyar származású Hevesy
György munkássága nyomán (aki 1943-ban kapott Nobel-díjat) kiderült, hogy a
nátrium ill. a kálium viszonylag gyorsan kicserélôdik a sejtek és környezetük
között. Az angol Keynes és Hodgkin kutatásai alapján (az utóbbi 1963-ban kapott
Nobel-díjat) arra is fény derült, hogy az ideg- és az izomszövet aktivitása során
nátriumionok tömege áramlik be az ingerlékeny sejtekbe, míg e sejtek nyugalmi
állapotában helyreáll a nátriumkoncentráció eredeti jelentôs különbsége.
A sejtek és környezetük között fennálló ionkoncentrációk különbségére a
magyarázat a sejthártyában elhelyezkedô aktív transzportrendszer,
az ATP energiáját igénylô nátrium–kálium pumpa mûködése. Az 1950-es évek
elején felismerték, hogy a sejtek ATP- tartalmának csökkentése vagy a
szívglikozidok hatására az ionkoncentrációk kiegyenlítôdése indul meg,
majd Gárdos és Straub 1954-es kísérletei azt is igazolták, hogy a vörösvérsejtekbe
mesterségesen bevitt ATP képes a káliumionok speciális eloszlásának elôidézésére.
Megindult tehát a kutatás az aktív nátrium- és káliumtranszport enzimatikus
alapjának felderítésére.
A tudás és talán a szerencse is Jens Skounak, az Aarhusi Egyetem akkor fiatal
kutatójának kedvezett, aki az ATP-t bontó ún. ATP-áz enzimek mûködését
vizsgálta. 1957-ben közölte elsô cikkét arról a jelenségrôl, hogy a finomra darált
rákidegrostokban egy olyan ATP-áz található, amelyet mind a nátrium-, mind a
káliumionok aktiválnak. Az általa Na+,K+–ATP-áz-nak elnevezett enzimet éppen
azok a nátrium- és káliumkoncentrációk stimulálták a legjobban, amelyek az
idegsejtekben jelen voltak, míg a szívglikozidok gátolták az ATP-hasítást. Rossz
nyelvek szerint Skou sokáig küzdött azzal, hogy mind a nátrium-, mind a
káliumionok csak igen kis aktiválást okoztak, míg egyszer egy hibás puffer-titrálás
miatt, amelynél mind kálium-, mind nátriumionokat tartalmazó lúgot használt,
végül is bekövetkezett a szenzációs, igen nagymértékû aktivitás-növekedés.
Jens Skou legnagyobb érdeme azonban az volt, hogy nemcsak felismerte a Na+,K+–
ATP-áz enzimet, hanem szinte azonnal össze is kapcsolta azt a sejtek és
környezetük között fennálló ionkülönbséggel. Megint csak a kutatók között
elterjedt legendák szerint ez úgy történt, hogy egy kaliforniai kongresszuson mind
Jens Skou, mind a vörösvérsejtek ionpumpáit kutató amerikai Robert Post a sötét és
unalmas kongresszusi termek helyett a Csendes-óceán partjának strandját
választották. Ahogy ott a nôket szemlélgetve beszélgettek, rájöttek, hogy
valószínûleg ugyanannak a jelenségnek két különbözô nézôpontját vizsgálják. (A
tanulság az is lehet, hogy az igazi kutató még szórakozás közben is csak a
munkájára gondol.)
2. ábra. A Na+,K+-ATP-áz vázlatos rajza. Az alfa alegység végzi a pumpamûködést,
míg a glikozilált béta alagység stabilizálja a fehérje szerkezetét. A Na+,K+-ATP-áz
az elektrokémiai gradienssel szemben nátriumionokot kifelé, káliumionokat a sejt
belseje felé pumpál. Egy ATP bontása 2 K+- és 3 Na+-ion transzportját teszi
lehetôvé. A pumpa specifikus gátlószerei, a szívglikozidok (pl. ouabain) a külsô,
K+-kötô helyen hatnak. Pi = szervetlen foszfátion (A "The Molecular Biology of
the Cell", szerzôk: Albers, Bray, Lewis, Raff, Roberts, Watson, Kiadó: Garland
Publ. Inc. nyomán).
Mindenesetre néhány év alatt valóban kiderült, hogy a sejtek nátrium–kálium
pumpájának alapja a Na+,K+–ATP-áz mûködése. Ma már tudjuk, hogy az enzim két
alegységbôl, az ATP hasítását és az ionok transzportját végzô alfa, és a
pumpaszerkezetet a membránban rögzítô, cukorkomponenseket is tartalmazó béta
alegységbôl épül fel (2. ábra). Az enzim a sejtmembrán belsô oldalán megköti a
nátriumionokat és az ATP-t, majd az ATP hasítása során az ATP egyik
foszfátcsoportja rákapcsolódik az enzimre. Ez az ún. foszforilált enzim
(EP) képviseli azt az energetizált formát, amely a nátriumionok "kipumpálására",
ill. a membrán külsô oldalán a káliumionok megkötése után azok "bepumpálására"
is képessé válik. A szívglikozidok a membrán külsô oldalán kapcsolódva gátolják a
pumpa mûködését, míg az elhasadt ATP-bôl az ADP és a foszfátion ismét a
membrán belsô oldalán szabadul fel (3. ábra).
3. ábra. A Na+,K+-ATP-áz (Na+,K+-pumpa) feltételezett mûködési mechanizmusa. 1.
A pumpa a citoplazmikus oldalon Na+-ionokat köt. 2. Az ATP hasítása nyomán a
foszfátion (P) az enzimhez kapcsolódik, kialakul az EP komplex. 3. A Na+-ionok
átkerülnek a sejt külsô oldalára, a foszfátcsoport még az enzimhez kötve marad. 4.
A sejt külsô oldalán K+-ionok kapcsolódnak az enzimhez. 5. Leválik az enzimrôl a
foszfátcsoport, a K+-ionok átkerülnek a sejtmembrán belsô oldalára. 6. A belsô
oldalon leválnak a K+-ionok. (A "The Molecular Biology of the Cell", szerzôk:
Albers, Bray, Lewis, Raff, Roberts, Watson, Kiadó: Garland Publ. Inc. nyomán).
Anélkül, hogy itt a Na+,K+–ATP-áz mûködését részleteznénk, fontos elmondani,
hogy ma már igen sok információval rendelkezünk a pumpa molekuláris
mechanizmusáról, ill. annak a különbözô szövetekben elôforduló változatairól. A
legfontosabb azonban az, hogy a nátrium–kálium pumpa az állatvilág szinte
valamennyi tagjának szinte valamennyi sejtjében az egyik legalapvetôbb
életfolyamat. Ez a pumpa biztosítja a legtöbb anyag transzportjához, vagy az
ingerület terjedéséhez és felfogásához szükséges "akkumulátor" feltöltését, a
membránpotenciál-különbség kialakulását, a sejttérfogat alapvetô szabályozását.
Így a képzôdô összes ATP mintegy harminc százalékát a nátrium–kálium pumpa
használja fel. Éppen ezért az agyban az ATP-szint csökkenése és e
pumpamechanizmus leállása már néhány perc alatt is megfordíthatatlan
károsodáshoz vezet.
A nátrium–kálium pumpa felfedezését követôen tisztázódott, hogy számos hasonló
iontranszport ATP-áz létezik, amelyek alapvetôen hasonló mûködési mechanizmust
mutatnak. Így az izomszövet aktív kálciumtranszport rendszerei, a sejtmembrán
kálciumpumpája, de a gyomorban mûködô, a sósavtermelésért
felelôs K+/H+ pumpa is az ATP-vel foszforilálódó, ún. P-típusú ATP-áz. Igaz, hogy
még az 1970-es években is nemzetközi vita folyt arról, egyáltalán létezhetnek-e
membránpumpák. Számos alternatív elképzelés látott azonban napvilágot, amely
pl. a sejten belüli fehérjekötéssel, vagy a víz speciális szerkezetével igyekezett
magyarázni az egyenlôtlen ioneloszlást. Az évek során azonban a pumpafehérjék
izolálása, mûködôképes membrán-visszaépítése, az ATP-függô transzport
biofizikai, elektromos és molekuláris bizonyítása egyértelmûen eloszlatta ezeket az
aggályokat. Ma már biztosan tudjuk, hogy a pumpafehérjék nélkül az élet
gyakorlatilag elképzelhetetlen, hiszen valamennyi sejt mûködésének alapfeltételét
jelentik.
Az ATP képzôdésének molekuláris mechanizmusa
Ahogy a bevezetôben említettük, az élô sejtek alapvetô energiaforrása az ATP. Az
1940-es és 50-es évek során tisztázódott, hogy az ATP legnagyobb része a sejteken
belül található mitokondriumokban, az oxidatív anyagcsere központjaiban
képzôdik. 1960-ban az amerikai Efraim Racker és munkatársai izolálták elôször a
késôbb ATP-szintetáznak elnevezett fehérje-komplexumot, az F1-F0-ATP-ázt. Már
az elnevezés is mutatja, hogy ez az enzim az ATP lebontására és képzésére
egyaránt képes, és csak a mitokondrium energiaállapota határozza meg, hogy
melyik irányba menjen a folyamat. Az F1-F0-ATP-áz számos alegységbôl felépülô
egyik fô része, az F1 a mitokondrium belseje felé nézô fehérjegombolyag, amely
az ATP hasítását vagy képzését végzi, míg az F0 rész a membránba beágyazott
fehérjék csoportja, amely egyben ion-csatornaként is mûködik (4. ábra).
Ugyanilyen szerkezetû komplex felelôs a baktériumokban, sôt a zöld növényekben,
a kloroplasztiszokban lejátszódó ATP-szintézisért is.
4. ábra. A mitokondriális ATP-szintetáz
felépítése és mûködése. A membránba
ágyazott F0 egység háromféle (a,b és c), a
mitokondrium belseje felé nézô F1 rész
ötféle (alfa, béta, gamma, delta és epszilon)
alegységbôl épül fel. A H+-ionok
áramlásának a hatására a c fehérjék
korongja elfordul, és így az ehhez
kapcsolódó gamma alegység is körbefordul.
Ugyanakkor az F1 többi fehérjéje nem tud
elfordulni (a béta rész a membránhoz
rögzül), így a középen elforgó
aszimmetrikus gamma alegység a béta
alegységekben szerkezeti változást okoz, ami
az ATP szintéziséhez vezet.
Az ATP-szintézis molekuláris mechanizmusáról az elsô átfogó képet az
angol Peter Mitchell alkotta, aki rájött, hogy a mitokondrium csak akkor
képes ATP-szintézisre, ha membránja két oldala között a hidrogénionok jelentôs
koncentrációkülönbsége alakul ki. A Mitchell által kidolgozott kemiozmotikus
hipotézis (amelyért 1978-ban Nobel-díjat kapott) ma is helytálló elképzelésnek
bizonyult. E szerint a tápanyagok oxidációjával keletkezô energia a mitokondrium
membrán két oldala között hidrogénion grádienst alakít ki, mintegy feltölt egy
"elemet", amelynek "kisülése", a hidrogénionok átáramlása az F0-fehérjén keresztül
vezet az ATP képzôdéséhez.
Az újdonsült Nobel-díjassok közül, Paul Boyer és John Walker e fenti
elképzelésnek az alapján dolgozta ki azt a molekuláris mechanizmust, amely
az ATP-szintézisért felelôs. Valódi "molekuláris motort" tártak fel, amelyben a
fehérje-komplex egyes elemei egymáshoz képest elmozdulva alakítják át a
hidrogénion-áramlás energiáját az ATP kémiai kötési energiájává. Ha tetszik,
szemléletesen ez egy olyan vízeséshez hasonlítható, amelyben az áramlási energia
egy kalapácsot mozgat, amely azután egy értékes pénzdarabot kovácsol.
Paul Boyer már az 1950-es évek óta részese volt annak a nagy tudományos
versenyfutásnak és ötletáradatnak, amely az ATP- szintézis egyes lépéseit vizsgálta.
Eredeti elképzelése ay volt, hogy az ATP-szintetáz, a legtöbb enzimmel szemben,
különleges módon nem közvetlenül a reakció katalizálásába, azaz
az ADP/ATP átalakításba fekteti az energiát, hanem az ADP és a foszfátion
megkötése, majd az ATP felszabadítása az energiaigényes lépés. Így vált lehetôvé,
hogy a kutatások most már az ADP, a foszfát és az ATP kötésére alkalmas
fehérjeszerkezetek vizsgálatára irányuljanak.
Éppen ezt a gondolatmenetet továbbvíve, az F1-fehérje ATP kötésre alkalmas
molekularészének felismeréséért nyerte el az idei Nobel-díj másik részét John
Walker. Az ATP-szintetáz aminosav sorrendjének analízise során az 1980-as évek
elején munkatársaival felismert olyan konzervatív (a legkülönbözôbb élôlényekben
is állandó) sorozatokat (szekvenciákat), amelyek az ATP kötéséért felelôsek. Ezt a
két egymáshoz fekvô, a kötôhelyet együttesen kialakító aminosav-csoportot
felfedezôje nyomán Walker-A– és Walker-B–szekvenciának nevezzük, és egyre
többet tudunk pontos térszerkezetérôl is. A felfedezést talán az tette igazán
alapvetôvé, hogy kiderült: az ATP-t használó enzimek, fehérjék legszélesebb
körében ugyanezek a megôrzött aminosav-sorrendek végzik az ATP megkötését.
Ma már ennek a Walker-szakasznak szinte diagnosztikus jelentôsége van egy-egy
új enzim mûködésének elôrejelzésében, feltérképezésében.
Érdemes néhány szóban összefoglalni, hogy mi is a jelenleg kialakult kép az ATP-
szintetáz enzim molekuláris gépezetének mûködésérôl. Maga az ATP-
képzôdés az F1 rész béta alegységén (4. ábra) történik, amelyen belül a gamma
alegység körkörös elfordulást végez. Az aszimmetrikus gamma alegység
körforgása változtatja meg a béta alegységek kötôképességét, amely azután az ATP
képzôdéséhez vezet. A legérdekesebb, hogy ezt a körforgást az F0 egység c
alegységén át érkezô hidrogénionok áramlása tartja fenn, azaz az F0 "tengelyén" az
F1 rész gamma alegysége a hidrogénion-áramlástól hajtva "pörög", és közben a béta
alegység az ADP-t és a foszfátiont ATP-vé kapcsolja össze.
A kutatók számára sokáig hihetetlennek tûnt, hogy egy valódi forgó gépezet, az
egymáson elcsúszva percenként többszázszor körbeforduló fehérjék mozgása
végezné az ATP szintézisét. Kétségtelenül igazolták azonban ezt a mechanizmust a
fehérjék kémiai keresztkötésével végzett blokkoló kísérletek, ill. az igen szellemes
mikroszkópos mérések. Amikor japán kutatók apró izomfehérje (aktin-) szálakat
kapcsoltak az egyik (gamma) alegységhez, a másik (béta) alegységet pedig
rögzítették, az ATP bontásához, ill. képzôdéséhez kapcsolva mikroszkóppal is
láthatóvá vált az aktinszálak gyors körbeforgása.
ATP-ázok és ATP-kötô fehérjék
A Nobel-díjak odaítélése után mindig felvetõdik a két kérdés, hogy miért
pont ôk, és miért pont most kapták az elismerést. Az elsôre a választ, úgy hisszük,
jól megadják az eddig elmondottak: az élet molekuláris alapjainak megismerésében
Skou, Boyer és Walker igazi maradandó alkotásokkal tette le a névjegyét. Hogy
miért pont most, Skou felfedezése után csaknem 40 évvel, Boyer és Walker
munkássága nyomán pedig 15–20 évvel született meg ez a díjazás, arra már jobban
felelhetne az általában igazán hatékony és elôrevivô tudománypolitikát képviselô
Nobel-bizottság szakmai testülete.
Mi csak gyanítjuk, hogy fel akarták hívni a figyelmet arra a tudományterületre,
amely napjainknak is egyik legérdekesebb, mintegy "húzó-ágazata". Ez a terület
nem más, mint a biológiai energia termelését és felhasználását végzô fehérjék
vizsgálata, hiszen az izomrostok után egyre több ATP-t használó molekuláris
motor, pl. a sejtosztódáskor a kromoszómákat "széthúzó" mitotikus orsó, vagy a
fehérjéket a sejt egyes tereibe átjuttató "húzó-vonó" szerkezetek mûködése tárul fel.
Mind a biotechnológia, mind az orvostudomány területén egyre nagyobb
érdeklôdés irányul ezekre a kérdésekre. Az is bebizonyosodott, hogy a sejteken
belüli jelátvitel részben az ionok transzportjának gyors megváltozásain, ill. a
különbözô fehérjék ATP-függô módosításán, foszforilációján alapul. Saját jelenlegi
kutatásainkat tekintve arra utalhatunk, hogy az utóbbi néhány évben ismertük meg
a transzport-ATP-ázok egy újabb csoportját, amelyeket a bennük található ATP-
kötô (ATP Binding Cassette) régió alapján ABC-transzportereknek neveznek.
Szinte természetes, hogy ezekben az ATP-ázokban is a Walker-A és Walker-
B aminosav-sorozatok képezik az ATP-kötô régiót. Ebbe a csoportba tartozik az az
1989-ben megismert fehérje, amelynek hibája a ma még halálos cisztás
fibrózis betegséget okozza, és az 1990-es években felfedezett, az immunrendszer
mûködésében fontos szerepet játszó peptid-transzporterek, vagy a daganatok
kemoterápia-rezisztenciájáért felelôs drogpumpáló fehérjék. Mindezek az új
felismerések is nagyban elôsegíthették, hogy az 1997-es Nobel-díjjal éppen az
ATP-t felhasználó, ill. termelô életfolyamatok kerüljenek a laikus és a kutatói
társadalom figyelmének elôterébe.
Természet Világa, 129. évf. 2. sz. 1998. február, 50–53. o.
https://www.kfki.hu/chemonet/TermVil/
https://www.ch.bme.hu/chemonet/TermVil/
You might also like
- 4 - TételDocument4 pages4 - TételViki100% (1)
- Notheisz Zsigmond Szerves Kemia JegyzetDocument186 pagesNotheisz Zsigmond Szerves Kemia JegyzetÉva KocsorNo ratings yet
- Gárdos GyörgyDocument8 pagesGárdos Györgyeszter09tothNo ratings yet
- Biokémia II - Anyagcserefolyamatok A SejtbenDocument8 pagesBiokémia II - Anyagcserefolyamatok A Sejtbenfelkészítés KemBioNo ratings yet
- Az ATP SzerkezeteDocument1 pageAz ATP Szerkezetegal.bertoldNo ratings yet
- 5 Történeti ÁttekintésDocument12 pages5 Történeti Áttekintésnigel agrippaNo ratings yet
- Ekt Megoldas VeglegesDocument40 pagesEkt Megoldas Veglegesgergo demokNo ratings yet
- Biokémia KidolgozvaDocument9 pagesBiokémia KidolgozvaSzabolcs MihalikNo ratings yet
- Fényenergia Megkötését Pigmentek (Pigments) Végzik - HUN - 2019Document25 pagesFényenergia Megkötését Pigmentek (Pigments) Végzik - HUN - 2019Juhász LászlóNo ratings yet
- Sejtbiol Kieg 2024Document7 pagesSejtbiol Kieg 2024Patrik InczeNo ratings yet
- 2.2 Az Anyagcsere FolyamataiDocument6 pages2.2 Az Anyagcsere Folyamataiadmedul642No ratings yet
- 003 F Hu 08 MitTranszport ATP AnnaDocument46 pages003 F Hu 08 MitTranszport ATP AnnaLili IvaskovicsNo ratings yet
- Biologiai OxidacioDocument19 pagesBiologiai OxidaciolacisagNo ratings yet
- Adenozin TrifoszfátDocument9 pagesAdenozin TrifoszfátszabkincsoNo ratings yet
- BiokémiaDocument35 pagesBiokémiaLudovika KissNo ratings yet
- PS Biologia FeladatmegoldasokDocument44 pagesPS Biologia Feladatmegoldasokvigh.akos2009No ratings yet
- BIOLÓGIA Középiskolásoknak, ÉrettségizőknekDocument44 pagesBIOLÓGIA Középiskolásoknak, ÉrettségizőknekasdNo ratings yet
- OsirisKonyvek 1494 Pages50-99Document50 pagesOsirisKonyvek 1494 Pages50-99Tamás BokorNo ratings yet
- 11.A FotoszintézisDocument14 pages11.A FotoszintézisMárton B.No ratings yet
- Nukleotid Típusú Vegyületek 2Document17 pagesNukleotid Típusú Vegyületek 2english.batta.krisztinaNo ratings yet
- 01-Mennyit Fogyaszt Az Agy - Akciós PotenciálDocument3 pages01-Mennyit Fogyaszt Az Agy - Akciós PotenciálFarkas György AntalNo ratings yet
- Mitokondriális Működészavar PDFDocument8 pagesMitokondriális Működészavar PDFEvi TohaiNo ratings yet
- BioszDocument3 pagesBiosztbeneeNo ratings yet
- Disszimilacio FaktDocument19 pagesDisszimilacio FaktDorottya HovaneczNo ratings yet
- A Biológiai Oxidáció FolyamataiDocument1 pageA Biológiai Oxidáció FolyamataiAnonymous mjrZLY8No ratings yet
- Integralt Szemleletu Feladatbank 9-90Document82 pagesIntegralt Szemleletu Feladatbank 9-90Simon IldikóNo ratings yet
- 0411 Dolgozat AnyagDocument12 pages0411 Dolgozat AnyagBán LeventeNo ratings yet
- A KromoszomaDocument327 pagesA Kromoszomagarfield262No ratings yet
- NukleotidokDocument3 pagesNukleotidoknanika2006nacsNo ratings yet
- 3 Sejtek Es SejtelettanDocument28 pages3 Sejtek Es SejtelettanSimonfi AgnesNo ratings yet
- DR - Kotorman Marta - A Feherjek Szerkezete Az Enzimkatalizis Jellemzese Enzimkinetika Az Enzimek Szabalyozasanak LehetosegeiDocument11 pagesDR - Kotorman Marta - A Feherjek Szerkezete Az Enzimkatalizis Jellemzese Enzimkinetika Az Enzimek Szabalyozasanak Lehetosegeihppp555No ratings yet
- Biokemia II 2Document92 pagesBiokemia II 2Janos GreenMasterNo ratings yet
- A Felepito FolyamatokDocument11 pagesA Felepito FolyamatokBán LeventeNo ratings yet
- Pránájáma Technikák Sejtélettani HáttereDocument6 pagesPránájáma Technikák Sejtélettani HáttereJózsef Csongor SelmeciNo ratings yet
- 1 Bevezetés. Kofaktorok. Protonációs EgyensúlyDocument29 pages1 Bevezetés. Kofaktorok. Protonációs Egyensúlynigel agrippaNo ratings yet
- 01 Sejtbiologia MinimumDocument27 pages01 Sejtbiologia MinimumEdi RNo ratings yet
- Nukleotidok, NukleinsavakDocument3 pagesNukleotidok, Nukleinsavaknanika2006nacsNo ratings yet
- 3 TranszlacioDocument46 pages3 Transzlaciohelgaa.balogNo ratings yet
- E Fotoszintezis7 PDFDocument3 pagesE Fotoszintezis7 PDFDavid AlexNo ratings yet
- Atom Model LekDocument49 pagesAtom Model LekLuna NapaNo ratings yet
- Az Atomok SzerkezeteDocument22 pagesAz Atomok SzerkezeteFrocsog100% (1)
- Növényfiziológia Tételek KidolgozvaDocument26 pagesNövényfiziológia Tételek KidolgozvaSipi SomOfNo ratings yet
- Terminális OxidációDocument32 pagesTerminális OxidációFehér DánielNo ratings yet
- Géczy Gábor - Lépések A Hosszú Élet Felé 2Document7 pagesGéczy Gábor - Lépések A Hosszú Élet Felé 2ozsvi0% (1)
- Biologia Felveteli Tetelek V 1999Document9 pagesBiologia Felveteli Tetelek V 1999Károly PappNo ratings yet
- Sejtbiológia ÖsszefoglalásokDocument35 pagesSejtbiológia ÖsszefoglalásokNemes NOémiNo ratings yet
- Biológiai Alapok I. Sejttan Csonttan IzomtanDocument48 pagesBiológiai Alapok I. Sejttan Csonttan IzomtanÉva BodnárNo ratings yet
- 03.13. Bikem JegyzetDocument3 pages03.13. Bikem Jegyzetbpeter0309No ratings yet
- A DNS Örökítő SzerepeDocument3 pagesA DNS Örökítő SzerepebcsmNo ratings yet
- Tesztkérdések Biokémia MetabolizmusDocument4 pagesTesztkérdések Biokémia MetabolizmusViktória KissNo ratings yet
- Anyagcsere Fot Biol - Ox. Gyakoló FeladatlapDocument2 pagesAnyagcsere Fot Biol - Ox. Gyakoló FeladatlapRbert2 HajduNo ratings yet
- Metabolizmus (Anyagcsere) 22Document7 pagesMetabolizmus (Anyagcsere) 22Roland JuonNo ratings yet
- Nukleinsavak BioszferaDocument6 pagesNukleinsavak BioszferaBéla KamuNo ratings yet
- A. E. Powell - Az Éteri Test - Csakrák - Prána - EgészségDocument71 pagesA. E. Powell - Az Éteri Test - Csakrák - Prána - EgészségTörök Mónika100% (1)
- VillonDocument3 pagesVilloneszter09tothNo ratings yet
- FogzománcDocument3 pagesFogzománceszter09tothNo ratings yet
- Letális AllélDocument4 pagesLetális Alléleszter09tothNo ratings yet
- A Zsíros Pör DevalválódikDocument5 pagesA Zsíros Pör Devalválódikeszter09tothNo ratings yet
- Az Emberi Szervezet Sejtjei És Szövete1Document4 pagesAz Emberi Szervezet Sejtjei És Szövete1eszter09tothNo ratings yet
- Mi Is Az A Ph-Érték, Amit A Rágógumi Visszaállít A Szánkban?Document8 pagesMi Is Az A Ph-Érték, Amit A Rágógumi Visszaállít A Szánkban?eszter09tothNo ratings yet
- Karinthy FrigyesDocument19 pagesKarinthy Frigyeseszter09tothNo ratings yet
- BEFEJEZÉSDocument3 pagesBEFEJEZÉSeszter09tothNo ratings yet
- PolitikaDocument2 pagesPolitikaeszter09tothNo ratings yet
- Metiléndioxi MetamfetaminDocument11 pagesMetiléndioxi Metamfetamineszter09tothNo ratings yet
- Spanyol KonyhaDocument15 pagesSpanyol Konyhaeszter09tothNo ratings yet
- SimaizomDocument3 pagesSimaizomeszter09tothNo ratings yet
- Hipochondria Tünetei És KezeléseDocument3 pagesHipochondria Tünetei És Kezeléseeszter09tothNo ratings yet
- Gárdos GyörgyDocument8 pagesGárdos Györgyeszter09tothNo ratings yet
- Az AcetilkolinDocument4 pagesAz Acetilkolineszter09tothNo ratings yet
- Légy Jó Mindhalálig - Móricz ZsigmondDocument149 pagesLégy Jó Mindhalálig - Móricz Zsigmondeszter09tothNo ratings yet
- János Vitéz Története Igazi Mese ArrólDocument2 pagesJános Vitéz Története Igazi Mese Arróleszter09tothNo ratings yet
- Gárdonyi GézaDocument4 pagesGárdonyi Gézaeszter09tothNo ratings yet
- DezoxiribonukleinsavDocument1 pageDezoxiribonukleinsaveszter09tothNo ratings yet
- Móricz ZsigmondDocument4 pagesMóricz Zsigmondeszter09tothNo ratings yet
- Adatok Ábrázolása Diagramon És GrafikononDocument16 pagesAdatok Ábrázolása Diagramon És Grafikononeszter09tothNo ratings yet
- Szteroidok És Teljesítményfokozók Alacsony ÁronDocument5 pagesSzteroidok És Teljesítményfokozók Alacsony Ároneszter09tothNo ratings yet
- Mindent A CsokirólDocument2 pagesMindent A Csokiróleszter09tothNo ratings yet
- Mi A PszichológiaDocument1 pageMi A Pszichológiaeszter09tothNo ratings yet
- MEGOLDOKULCSDocument2 pagesMEGOLDOKULCSeszter09tothNo ratings yet
- MicimackoDocument2 pagesMicimackoeszter09tothNo ratings yet
- Mikor Jó És Mikor Ellenjavalt Fájdalomcsillapító Az AcetilszalicilsavDocument4 pagesMikor Jó És Mikor Ellenjavalt Fájdalomcsillapító Az Acetilszalicilsaveszter09tothNo ratings yet
- Az LCM Lineáris Szállítópályás Modul Egy Olyan SzállítórendszerDocument1 pageAz LCM Lineáris Szállítópályás Modul Egy Olyan Szállítórendszereszter09tothNo ratings yet
- Ibolya Kek FelelmekDocument1 pageIbolya Kek Felelmekeszter09tothNo ratings yet
- Víz VilágnapjaDocument4 pagesVíz Világnapjaeszter09tothNo ratings yet