Professional Documents
Culture Documents
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Uploaded by
ScribdTranslationsCopyright:
Available Formats
You might also like
- Diagramas de PiperDocument10 pagesDiagramas de PiperAndre RosalesNo ratings yet
- Seminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosDocument9 pagesSeminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosPatricio AlmadaNo ratings yet
- MCO - Fuerzas Intermoleculares UnicaDocument31 pagesMCO - Fuerzas Intermoleculares UnicaAnthony EdgarNo ratings yet
- Fuerzas IntermolecularesDocument2 pagesFuerzas IntermolecularesValentina80% (5)
- Fuerzas IntermolecularesDocument2 pagesFuerzas IntermolecularesDanna Ramírez100% (2)
- ACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QADocument23 pagesACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QAJuli WidnikiewiczNo ratings yet
- Fuerzas Intermoleculares.Document22 pagesFuerzas Intermoleculares.EfraínNo ratings yet
- Monografia de QuimicaDocument8 pagesMonografia de QuimicaJoa King Chaupis AdrianoNo ratings yet
- Clase 3Document27 pagesClase 3Leonel Andrés Mendoza MalagónNo ratings yet
- Fuerzas IntermolecularesDocument12 pagesFuerzas IntermolecularesRenzoNo ratings yet
- Estructura y Propiedades de Los Compuestos Quimicos Organicos PDFDocument11 pagesEstructura y Propiedades de Los Compuestos Quimicos Organicos PDFBarbara MendaNo ratings yet
- BrayanDocument12 pagesBrayanBrayan Ayna RamosNo ratings yet
- Informe Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)Document10 pagesInforme Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)HARRISON STEVE LIBERATO CASTRONo ratings yet
- Líquidos y SólidosDocument42 pagesLíquidos y SólidosJuan Sebastian GilNo ratings yet
- Semana 5 Fuerzas Intermoleculares 2024-1Document28 pagesSemana 5 Fuerzas Intermoleculares 2024-1PRINS JEREMY VILLEGAS JULCANo ratings yet
- Fuerzas IntermolecularesDocument13 pagesFuerzas Intermoleculareserick joelNo ratings yet
- Taller 8..Document7 pagesTaller 8..Luz Marina Peña MorajxkfjjkkzkfNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesCarmeny NavaNo ratings yet
- Guía de Estudio para El Estado SólidoDocument6 pagesGuía de Estudio para El Estado SólidoFlorencia HernandezNo ratings yet
- Química General II ExamenDocument6 pagesQuímica General II ExamenAyrton SangabrielNo ratings yet
- Fuerzas Intermoleculares Quimica 1Document45 pagesFuerzas Intermoleculares Quimica 1Esteban CastilloNo ratings yet
- Sesià N 5Document28 pagesSesià N 5Matias AguilarNo ratings yet
- 12) Fuerzas IntermolecularesDocument6 pages12) Fuerzas Intermolecularessoledadfigueroa717No ratings yet
- Teoría - Fuerzas IntermolecularesDocument15 pagesTeoría - Fuerzas Intermolecularesbruno marettoNo ratings yet
- Sem 2 Teoria 3 PPT - 240331 - 215614Document16 pagesSem 2 Teoria 3 PPT - 240331 - 215614javier sandovalNo ratings yet
- Lección 2 Fuerzas IntermolecularesDocument13 pagesLección 2 Fuerzas IntermolecularesScribdTranslationsNo ratings yet
- Tema 2Document82 pagesTema 2Francisco GonzalezNo ratings yet
- Adhesión y Cohesión PDFDocument29 pagesAdhesión y Cohesión PDFJulio & Alejandra proyecto integradorNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesJhonAlexanderCeballosSanchezNo ratings yet
- Tema 3 Enlace QuímicoDocument20 pagesTema 3 Enlace Químicounai 007No ratings yet
- Clase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017Document34 pagesClase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017luisNo ratings yet
- Fuerzas Intermoleculares - Lecturas.Document8 pagesFuerzas Intermoleculares - Lecturas.Karol ErazoNo ratings yet
- Estados de Agregaciã N de La MateriaDocument14 pagesEstados de Agregaciã N de La MateriaMaria CamilaNo ratings yet
- Laboratorio de Química OrgánicaDocument23 pagesLaboratorio de Química Orgánicamarlene-stemkeNo ratings yet
- 2° Taller de Química OrgánicaDocument4 pages2° Taller de Química OrgánicaAldair ARNo ratings yet
- Estados de Agregación de La Materia PDFDocument14 pagesEstados de Agregación de La Materia PDFdavid stNo ratings yet
- LABORATORIO 4 UnionesDocument7 pagesLABORATORIO 4 UnionesDiego Hernandez0% (1)
- Presentación de Fuerzas Intermoleculares 2020aDocument37 pagesPresentación de Fuerzas Intermoleculares 2020aleninNo ratings yet
- Interacciones Intrermoleculares: Interacciones Electroestaticas Interacciones InductivasDocument1 pageInteracciones Intrermoleculares: Interacciones Electroestaticas Interacciones InductivasPalo LibrandiNo ratings yet
- Fuerzas IntramolecularesDocument1 pageFuerzas IntramolecularesAnto RaspudichNo ratings yet
- Fuerzas Intermoleculares, Javier CorralesDocument5 pagesFuerzas Intermoleculares, Javier Corralesjavier.corralesNo ratings yet
- Enlaces QuímicosDocument12 pagesEnlaces QuímicosGabriel GarcíaNo ratings yet
- Enlace Ionico Vs CovalenteDocument10 pagesEnlace Ionico Vs CovalenteIvonne BustamanteNo ratings yet
- Fuerzas Intermoleculares Dipolo - DipoloDocument2 pagesFuerzas Intermoleculares Dipolo - DipoloLaura BazánNo ratings yet
- Cuadro ComparativoDocument11 pagesCuadro ComparativoAlejandro RochaNo ratings yet
- Actividad 5 - Quimica - Cuadro ComparativoDocument6 pagesActividad 5 - Quimica - Cuadro ComparativoArmando MorenoNo ratings yet
- Unidad Ll. Termodinamica de FasesDocument76 pagesUnidad Ll. Termodinamica de Faseslitog72210No ratings yet
- Quimica Dif Presentacion Fuerzas IntermolecularesDocument15 pagesQuimica Dif Presentacion Fuerzas IntermolecularesTony LedesmaNo ratings yet
- Uniones Quimicas 208962 Downloadable 4393623Document4 pagesUniones Quimicas 208962 Downloadable 4393623Rodrigo DiazNo ratings yet
- Fuerzas IntermolecularesDocument9 pagesFuerzas IntermoleculareslauraosoriocNo ratings yet
- Fuerzas Intermoleculares-1Document23 pagesFuerzas Intermoleculares-1gaimeschilquebelenNo ratings yet
- Muestra Tema 43Document8 pagesMuestra Tema 43LngNo ratings yet
- Enlaces QuímicosDocument46 pagesEnlaces QuímicosCindy GutiérrezNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesecmNo ratings yet
- 7.2 Fuerzas IntermolecularesDocument25 pages7.2 Fuerzas IntermolecularesNazareno DíazNo ratings yet
- 5 4-QuimicaDocument3 pages5 4-QuimicaSelene Vilca PoloNo ratings yet
- Fuerzas IntermolecularesDocument15 pagesFuerzas IntermolecularesWendy CedeñoNo ratings yet
- Fuerzas IntermolecularesDocument4 pagesFuerzas IntermolecularesNicolas Meza OrtegaNo ratings yet
- INTRODUCCIONDocument9 pagesINTRODUCCIONDiego Hernandez CisnerosNo ratings yet
- Un Plan de Lección Detallado en Inglés COMUNICACIÓN ORALDocument5 pagesUn Plan de Lección Detallado en Inglés COMUNICACIÓN ORALScribdTranslationsNo ratings yet
- Gestión Del Comedor Escolar Junto Con El Comportamiento de Los Clientes EstudiantesDocument17 pagesGestión Del Comedor Escolar Junto Con El Comportamiento de Los Clientes EstudiantesScribdTranslationsNo ratings yet
- Fluido No NewtonianoDocument37 pagesFluido No NewtonianoScribdTranslationsNo ratings yet
- No TejidoDocument9 pagesNo TejidoScribdTranslationsNo ratings yet
- Informe de Viaje Industrial CIPLA PDFDocument43 pagesInforme de Viaje Industrial CIPLA PDFScribdTranslationsNo ratings yet
- Investigación en El Desarrollo Del Niño y Del AdolescenteDocument44 pagesInvestigación en El Desarrollo Del Niño y Del AdolescenteScribdTranslationsNo ratings yet
- Sermón de Año NuevoDocument37 pagesSermón de Año NuevoScribdTranslationsNo ratings yet
- ShopeeFood - BD Pitch Deck de DiciembreDocument20 pagesShopeeFood - BD Pitch Deck de DiciembreScribdTranslationsNo ratings yet
- Formato de Póliza de Seguro de VehículoDocument5 pagesFormato de Póliza de Seguro de VehículoScribdTranslationsNo ratings yet
- Corrección InstitucionalDocument18 pagesCorrección InstitucionalScribdTranslationsNo ratings yet
- Universidad Nueva EraDocument11 pagesUniversidad Nueva EraScribdTranslationsNo ratings yet
- Critica La AlegríaDocument6 pagesCritica La AlegríaScribdTranslationsNo ratings yet
- 708 Restaurante SOPDocument253 pages708 Restaurante SOPScribdTranslationsNo ratings yet
- Memorial Por Un Problema de AgravioDocument15 pagesMemorial Por Un Problema de AgravioScribdTranslationsNo ratings yet
- Libro de Reglas de Registro de SLIITDocument30 pagesLibro de Reglas de Registro de SLIITScribdTranslationsNo ratings yet
- Plan de Negocios de Una Compañía Aérea Económica.Document49 pagesPlan de Negocios de Una Compañía Aérea Económica.ScribdTranslationsNo ratings yet
- MD Pediatría - Plan de Tesis (Año 2016)Document5 pagesMD Pediatría - Plan de Tesis (Año 2016)ScribdTranslationsNo ratings yet
- Propuesta de Utilización de MaquinariaDocument2 pagesPropuesta de Utilización de MaquinariaScribdTranslationsNo ratings yet
- Teoría y Crítica Literarias Una Guía de Oxford PDFDocument4 pagesTeoría y Crítica Literarias Una Guía de Oxford PDFScribdTranslationsNo ratings yet
- Abreviaturas, Prefijos y Sufijos de EnfermeríaDocument11 pagesAbreviaturas, Prefijos y Sufijos de EnfermeríaScribdTranslationsNo ratings yet
- Reglas de Acentuación de PalabrasDocument26 pagesReglas de Acentuación de PalabrasScribdTranslationsNo ratings yet
- Motor SincrónicoDocument11 pagesMotor SincrónicoScribdTranslationsNo ratings yet
- Aplicación de PruebaDocument30 pagesAplicación de PruebaScribdTranslationsNo ratings yet
- Diseño de Actividades Del Mes de La NutriciónDocument2 pagesDiseño de Actividades Del Mes de La NutriciónScribdTranslationsNo ratings yet
- Cobertura Final Lea 3Document9 pagesCobertura Final Lea 3ScribdTranslationsNo ratings yet
- Prueba de Ciencias Ambientales 1Document5 pagesPrueba de Ciencias Ambientales 1ScribdTranslationsNo ratings yet
- Notas MÉTODOS CUALITATIVOS Y CUANTITATIVOSDocument4 pagesNotas MÉTODOS CUALITATIVOS Y CUANTITATIVOSScribdTranslationsNo ratings yet
- Política, 2. Edición (Andrew Heywood) NotasDocument10 pagesPolítica, 2. Edición (Andrew Heywood) NotasScribdTranslationsNo ratings yet
- Plantilla de Procedimiento de PinturaDocument17 pagesPlantilla de Procedimiento de PinturaScribdTranslationsNo ratings yet
- No Eres Dueño de Tu VehículoDocument5 pagesNo Eres Dueño de Tu VehículoScribdTranslationsNo ratings yet
- Enlaces Quimicos PDFDocument43 pagesEnlaces Quimicos PDFcarolina casas cardenasNo ratings yet
- Ejercicios Regla Del OctetoDocument1 pageEjercicios Regla Del OctetoJuanPabloMarin100% (1)
- Mecanismos de Reaccion OrganicaDocument216 pagesMecanismos de Reaccion OrganicaDenesis TejedaNo ratings yet
- Tipos de Enlaces en La Formacionde BiomoleculasDocument2 pagesTipos de Enlaces en La Formacionde BiomoleculasDanna Elvia Meza MedinaNo ratings yet
- Enlace QuimicoDocument6 pagesEnlace QuimicoShirly Torres MejiaNo ratings yet
- Unmsm - Sesion 5 - Practica Dirigida - Enlace Interatomico y MolecularDocument6 pagesUnmsm - Sesion 5 - Practica Dirigida - Enlace Interatomico y MolecularLUIS ANGEL MAMANI PALMANo ratings yet
- Leccion 4. Enlace Quimico (Estructura de Lewis)Document4 pagesLeccion 4. Enlace Quimico (Estructura de Lewis)DIEGO BORBOLLANo ratings yet
- Diagrama de Los Orbitales MolecularesDocument3 pagesDiagrama de Los Orbitales MolecularesJosue MarquezNo ratings yet
- Unidad 2 SubDocument12 pagesUnidad 2 SubNicolás GrinbergNo ratings yet
- Respuestas A Problemas SeleccionadosDocument3 pagesRespuestas A Problemas SeleccionadosMontseVillegasNo ratings yet
- Geometria Molecular PresentarDocument61 pagesGeometria Molecular Presentaralexisdario100% (2)
- Teoria de Orbitales MolecularesDocument13 pagesTeoria de Orbitales MolecularesDalia Soria100% (1)
- FUERZAS IntermolecularesDocument15 pagesFUERZAS Intermolecularesdannaeh gomez cortesNo ratings yet
- Regla Del Octeto y Estructura de LewisDocument5 pagesRegla Del Octeto y Estructura de Lewisdavid pertuzNo ratings yet
- QUÍMICADocument55 pagesQUÍMICAmilagros galanNo ratings yet
- Configuracion ElectronicaDocument43 pagesConfiguracion ElectronicaJuan Carlos Leon MartinezNo ratings yet
- Hibridación (Química)Document3 pagesHibridación (Química)José MoralesNo ratings yet
- ResonanciaDocument11 pagesResonanciaIthaisa RodríguezNo ratings yet
- Geometría MolecularDocument4 pagesGeometría MolecularALANNo ratings yet
- Enlace IónicoDocument13 pagesEnlace IónicoJuan MiguelNo ratings yet
- 1.-¿Qué Son Las Fuerzas Intermoleculares?Document4 pages1.-¿Qué Son Las Fuerzas Intermoleculares?yami vieraNo ratings yet
- Enlaces QuímicosDocument4 pagesEnlaces QuímicosChiluisa EdisonNo ratings yet
- Enlace QuímicoDocument180 pagesEnlace QuímicoJose Ignacio Flores GonzalesNo ratings yet
- Ejercicios EnlaceDocument2 pagesEjercicios Enlacevictor huayhua choqueticoNo ratings yet
- Actividad 2 Periodicidad QuímicaDocument1 pageActividad 2 Periodicidad QuímicaEsteban Sarrazola RendonNo ratings yet
- Exposicion de InorganicaDocument4 pagesExposicion de InorganicaRocio Diaz TrujanoNo ratings yet
- IntroducciónDocument58 pagesIntroducciónJaime RodriguezNo ratings yet
- UNA FIESTA ELEMENTAL Jueves 08Document4 pagesUNA FIESTA ELEMENTAL Jueves 08DIANACRISRONo ratings yet
- Enlace Químico y Nomenclatura Inorgánica 2019Document70 pagesEnlace Químico y Nomenclatura Inorgánica 2019alexisNo ratings yet
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Uploaded by
ScribdTranslationsOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Lección 1 Modelo Molecular Cinético de Sólido y Líquido
Uploaded by
ScribdTranslationsCopyright:
Available Formats
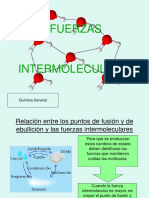
LECCIÓN 1 MODELO MOLECULAR CINÉTICO DE
SÓLIDO Y LÍQUIDO
Características de los sólidos y líquidos
Fuerza intermolecular de atracción
- Existen fuerzas de atracción entre partículas de
sustancias.
Modelo cinético molecular de sólidos y líquidos. - Por otra parte, la fuerza de atracción entre moléculas
vecinas (partículas de compuestos covalentes) es
- Explica las propiedades de los sólidos y los líquidos más débil que entre unidades de fórmula porque la
en términos de las fuerzas de atracción atracción molecular implica sólo cargas parciales.
intermoleculares y la energía cinética de las partículas
individuales. - Las fuerzas de atracción intermoleculares en
sustancias puras se conocen colectivamente como
o Fuerza intermolecular: fuerzas de atracción entre van der Waals .
partículas vecinas de una o más sustancias:
atraen las partículas (sólidas).
Fuerzas dipolo-dipolo
o Energía Cinética: mantiene las partículas a
distancia o se mueve (líquido). También depende - Experimentado a través de la polaridad; Ocurre
de la temperatura de la sustancia. Ocurre cuando cuando hay polaridad en otras moléculas.
el líquido se mueve de vez en cuando.
- Las moléculas polares existentes , como el cloruro de
- Ambos varían según la temperatura ( temperatura hidrógeno (HCl), son aquellas que poseen un
más baja, fuerza más alta) (temperatura más alta, momento dipolar permanente atribuido a la diferencia
fuerza más baja ) de electronegatividad de los átomos que los
componen y a cómo se organizan estos átomos en el
espacio.
- Combinación con no metal
Enlaces de hidrógeno
- Un tipo especial de interacción dipolo-dipolo que
existe sólo en moléculas que contienen un átomo de
hidrógeno unido a un átomo pequeño y altamente
electronegativo como N, O o F.
- Hidrógeno + átomo altamente electronegativo N, O o
F.
- El enlace de hidrógeno es entre 5 y 10 veces más
fuerte que otras interacciones dipolo-dipolo.
Ejemplo: dióxido de carbono Ejemplo: H 2 O, NH 3
Polaridad: CO 2 , H 2 O, NH 3
No polar debido a que tiene moléculas pares: O 2
++ / -- repeler
+- atraer
Polaridad: ni siquiera las moléculas
Dipolo de iones
- Fuerza que actúa entre un ion ( positivo (catión) o
negativo (anión) ) y una molécula polar.
Ejemplo: NaCl y moléculas de agua (polares)
- Se transforma debido al movimiento de los electrones
y ocurre durante mucho tiempo.
- El que tiene menor cantidad de electrones se vuelve
parcialmente positivo porque la presencia de un
electrón no es suficiente.
- El lado derecho no es parcialmente positivo porque se
le añadió un electrón .
Dispersión de Londres - Los átomos se remodelaron debido al movimiento de
los electrones .
- Las fuerzas de dispersión son fuerzas de atracción
intermoleculares que existen entre todos los átomos y
moléculas.
Ejemplo:
- Surgen del movimiento continuo de electrones en las ¿Qué tipo de fuerza intermolecular actuará en las
partículas. siguientes sustancias?
- Cargas estables de átomo y molécula o gas no polar. 1. Dióxido de azufre (SO 2 ) = Fuerza dipolo-dipolo
o Las moléculas polares se producen cuando hay 2. Gas nitrógeno (N 2 ) = Dispersión de Londres
una diferencia de electronegatividad entre los
átomos unidos. Moléculas desiguales. 3. Fluoruro de hidrógeno (HF) = Enlace de hidrógeno
o Las moléculas no polares ocurren cuando los
electrones se comparten por igual entre los
átomos de una molécula diatómica o cuando los
enlaces polares en una molécula más grande se
cancelan entre sí. Formas de gas; moléculas
iguales
You might also like
- Diagramas de PiperDocument10 pagesDiagramas de PiperAndre RosalesNo ratings yet
- Seminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosDocument9 pagesSeminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosPatricio AlmadaNo ratings yet
- MCO - Fuerzas Intermoleculares UnicaDocument31 pagesMCO - Fuerzas Intermoleculares UnicaAnthony EdgarNo ratings yet
- Fuerzas IntermolecularesDocument2 pagesFuerzas IntermolecularesValentina80% (5)
- Fuerzas IntermolecularesDocument2 pagesFuerzas IntermolecularesDanna Ramírez100% (2)
- ACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QADocument23 pagesACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QAJuli WidnikiewiczNo ratings yet
- Fuerzas Intermoleculares.Document22 pagesFuerzas Intermoleculares.EfraínNo ratings yet
- Monografia de QuimicaDocument8 pagesMonografia de QuimicaJoa King Chaupis AdrianoNo ratings yet
- Clase 3Document27 pagesClase 3Leonel Andrés Mendoza MalagónNo ratings yet
- Fuerzas IntermolecularesDocument12 pagesFuerzas IntermolecularesRenzoNo ratings yet
- Estructura y Propiedades de Los Compuestos Quimicos Organicos PDFDocument11 pagesEstructura y Propiedades de Los Compuestos Quimicos Organicos PDFBarbara MendaNo ratings yet
- BrayanDocument12 pagesBrayanBrayan Ayna RamosNo ratings yet
- Informe Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)Document10 pagesInforme Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)HARRISON STEVE LIBERATO CASTRONo ratings yet
- Líquidos y SólidosDocument42 pagesLíquidos y SólidosJuan Sebastian GilNo ratings yet
- Semana 5 Fuerzas Intermoleculares 2024-1Document28 pagesSemana 5 Fuerzas Intermoleculares 2024-1PRINS JEREMY VILLEGAS JULCANo ratings yet
- Fuerzas IntermolecularesDocument13 pagesFuerzas Intermoleculareserick joelNo ratings yet
- Taller 8..Document7 pagesTaller 8..Luz Marina Peña MorajxkfjjkkzkfNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesCarmeny NavaNo ratings yet
- Guía de Estudio para El Estado SólidoDocument6 pagesGuía de Estudio para El Estado SólidoFlorencia HernandezNo ratings yet
- Química General II ExamenDocument6 pagesQuímica General II ExamenAyrton SangabrielNo ratings yet
- Fuerzas Intermoleculares Quimica 1Document45 pagesFuerzas Intermoleculares Quimica 1Esteban CastilloNo ratings yet
- Sesià N 5Document28 pagesSesià N 5Matias AguilarNo ratings yet
- 12) Fuerzas IntermolecularesDocument6 pages12) Fuerzas Intermolecularessoledadfigueroa717No ratings yet
- Teoría - Fuerzas IntermolecularesDocument15 pagesTeoría - Fuerzas Intermolecularesbruno marettoNo ratings yet
- Sem 2 Teoria 3 PPT - 240331 - 215614Document16 pagesSem 2 Teoria 3 PPT - 240331 - 215614javier sandovalNo ratings yet
- Lección 2 Fuerzas IntermolecularesDocument13 pagesLección 2 Fuerzas IntermolecularesScribdTranslationsNo ratings yet
- Tema 2Document82 pagesTema 2Francisco GonzalezNo ratings yet
- Adhesión y Cohesión PDFDocument29 pagesAdhesión y Cohesión PDFJulio & Alejandra proyecto integradorNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesJhonAlexanderCeballosSanchezNo ratings yet
- Tema 3 Enlace QuímicoDocument20 pagesTema 3 Enlace Químicounai 007No ratings yet
- Clase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017Document34 pagesClase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017luisNo ratings yet
- Fuerzas Intermoleculares - Lecturas.Document8 pagesFuerzas Intermoleculares - Lecturas.Karol ErazoNo ratings yet
- Estados de Agregaciã N de La MateriaDocument14 pagesEstados de Agregaciã N de La MateriaMaria CamilaNo ratings yet
- Laboratorio de Química OrgánicaDocument23 pagesLaboratorio de Química Orgánicamarlene-stemkeNo ratings yet
- 2° Taller de Química OrgánicaDocument4 pages2° Taller de Química OrgánicaAldair ARNo ratings yet
- Estados de Agregación de La Materia PDFDocument14 pagesEstados de Agregación de La Materia PDFdavid stNo ratings yet
- LABORATORIO 4 UnionesDocument7 pagesLABORATORIO 4 UnionesDiego Hernandez0% (1)
- Presentación de Fuerzas Intermoleculares 2020aDocument37 pagesPresentación de Fuerzas Intermoleculares 2020aleninNo ratings yet
- Interacciones Intrermoleculares: Interacciones Electroestaticas Interacciones InductivasDocument1 pageInteracciones Intrermoleculares: Interacciones Electroestaticas Interacciones InductivasPalo LibrandiNo ratings yet
- Fuerzas IntramolecularesDocument1 pageFuerzas IntramolecularesAnto RaspudichNo ratings yet
- Fuerzas Intermoleculares, Javier CorralesDocument5 pagesFuerzas Intermoleculares, Javier Corralesjavier.corralesNo ratings yet
- Enlaces QuímicosDocument12 pagesEnlaces QuímicosGabriel GarcíaNo ratings yet
- Enlace Ionico Vs CovalenteDocument10 pagesEnlace Ionico Vs CovalenteIvonne BustamanteNo ratings yet
- Fuerzas Intermoleculares Dipolo - DipoloDocument2 pagesFuerzas Intermoleculares Dipolo - DipoloLaura BazánNo ratings yet
- Cuadro ComparativoDocument11 pagesCuadro ComparativoAlejandro RochaNo ratings yet
- Actividad 5 - Quimica - Cuadro ComparativoDocument6 pagesActividad 5 - Quimica - Cuadro ComparativoArmando MorenoNo ratings yet
- Unidad Ll. Termodinamica de FasesDocument76 pagesUnidad Ll. Termodinamica de Faseslitog72210No ratings yet
- Quimica Dif Presentacion Fuerzas IntermolecularesDocument15 pagesQuimica Dif Presentacion Fuerzas IntermolecularesTony LedesmaNo ratings yet
- Uniones Quimicas 208962 Downloadable 4393623Document4 pagesUniones Quimicas 208962 Downloadable 4393623Rodrigo DiazNo ratings yet
- Fuerzas IntermolecularesDocument9 pagesFuerzas IntermoleculareslauraosoriocNo ratings yet
- Fuerzas Intermoleculares-1Document23 pagesFuerzas Intermoleculares-1gaimeschilquebelenNo ratings yet
- Muestra Tema 43Document8 pagesMuestra Tema 43LngNo ratings yet
- Enlaces QuímicosDocument46 pagesEnlaces QuímicosCindy GutiérrezNo ratings yet
- Fuerzas IntermolecularesDocument7 pagesFuerzas IntermolecularesecmNo ratings yet
- 7.2 Fuerzas IntermolecularesDocument25 pages7.2 Fuerzas IntermolecularesNazareno DíazNo ratings yet
- 5 4-QuimicaDocument3 pages5 4-QuimicaSelene Vilca PoloNo ratings yet
- Fuerzas IntermolecularesDocument15 pagesFuerzas IntermolecularesWendy CedeñoNo ratings yet
- Fuerzas IntermolecularesDocument4 pagesFuerzas IntermolecularesNicolas Meza OrtegaNo ratings yet
- INTRODUCCIONDocument9 pagesINTRODUCCIONDiego Hernandez CisnerosNo ratings yet
- Un Plan de Lección Detallado en Inglés COMUNICACIÓN ORALDocument5 pagesUn Plan de Lección Detallado en Inglés COMUNICACIÓN ORALScribdTranslationsNo ratings yet
- Gestión Del Comedor Escolar Junto Con El Comportamiento de Los Clientes EstudiantesDocument17 pagesGestión Del Comedor Escolar Junto Con El Comportamiento de Los Clientes EstudiantesScribdTranslationsNo ratings yet
- Fluido No NewtonianoDocument37 pagesFluido No NewtonianoScribdTranslationsNo ratings yet
- No TejidoDocument9 pagesNo TejidoScribdTranslationsNo ratings yet
- Informe de Viaje Industrial CIPLA PDFDocument43 pagesInforme de Viaje Industrial CIPLA PDFScribdTranslationsNo ratings yet
- Investigación en El Desarrollo Del Niño y Del AdolescenteDocument44 pagesInvestigación en El Desarrollo Del Niño y Del AdolescenteScribdTranslationsNo ratings yet
- Sermón de Año NuevoDocument37 pagesSermón de Año NuevoScribdTranslationsNo ratings yet
- ShopeeFood - BD Pitch Deck de DiciembreDocument20 pagesShopeeFood - BD Pitch Deck de DiciembreScribdTranslationsNo ratings yet
- Formato de Póliza de Seguro de VehículoDocument5 pagesFormato de Póliza de Seguro de VehículoScribdTranslationsNo ratings yet
- Corrección InstitucionalDocument18 pagesCorrección InstitucionalScribdTranslationsNo ratings yet
- Universidad Nueva EraDocument11 pagesUniversidad Nueva EraScribdTranslationsNo ratings yet
- Critica La AlegríaDocument6 pagesCritica La AlegríaScribdTranslationsNo ratings yet
- 708 Restaurante SOPDocument253 pages708 Restaurante SOPScribdTranslationsNo ratings yet
- Memorial Por Un Problema de AgravioDocument15 pagesMemorial Por Un Problema de AgravioScribdTranslationsNo ratings yet
- Libro de Reglas de Registro de SLIITDocument30 pagesLibro de Reglas de Registro de SLIITScribdTranslationsNo ratings yet
- Plan de Negocios de Una Compañía Aérea Económica.Document49 pagesPlan de Negocios de Una Compañía Aérea Económica.ScribdTranslationsNo ratings yet
- MD Pediatría - Plan de Tesis (Año 2016)Document5 pagesMD Pediatría - Plan de Tesis (Año 2016)ScribdTranslationsNo ratings yet
- Propuesta de Utilización de MaquinariaDocument2 pagesPropuesta de Utilización de MaquinariaScribdTranslationsNo ratings yet
- Teoría y Crítica Literarias Una Guía de Oxford PDFDocument4 pagesTeoría y Crítica Literarias Una Guía de Oxford PDFScribdTranslationsNo ratings yet
- Abreviaturas, Prefijos y Sufijos de EnfermeríaDocument11 pagesAbreviaturas, Prefijos y Sufijos de EnfermeríaScribdTranslationsNo ratings yet
- Reglas de Acentuación de PalabrasDocument26 pagesReglas de Acentuación de PalabrasScribdTranslationsNo ratings yet
- Motor SincrónicoDocument11 pagesMotor SincrónicoScribdTranslationsNo ratings yet
- Aplicación de PruebaDocument30 pagesAplicación de PruebaScribdTranslationsNo ratings yet
- Diseño de Actividades Del Mes de La NutriciónDocument2 pagesDiseño de Actividades Del Mes de La NutriciónScribdTranslationsNo ratings yet
- Cobertura Final Lea 3Document9 pagesCobertura Final Lea 3ScribdTranslationsNo ratings yet
- Prueba de Ciencias Ambientales 1Document5 pagesPrueba de Ciencias Ambientales 1ScribdTranslationsNo ratings yet
- Notas MÉTODOS CUALITATIVOS Y CUANTITATIVOSDocument4 pagesNotas MÉTODOS CUALITATIVOS Y CUANTITATIVOSScribdTranslationsNo ratings yet
- Política, 2. Edición (Andrew Heywood) NotasDocument10 pagesPolítica, 2. Edición (Andrew Heywood) NotasScribdTranslationsNo ratings yet
- Plantilla de Procedimiento de PinturaDocument17 pagesPlantilla de Procedimiento de PinturaScribdTranslationsNo ratings yet
- No Eres Dueño de Tu VehículoDocument5 pagesNo Eres Dueño de Tu VehículoScribdTranslationsNo ratings yet
- Enlaces Quimicos PDFDocument43 pagesEnlaces Quimicos PDFcarolina casas cardenasNo ratings yet
- Ejercicios Regla Del OctetoDocument1 pageEjercicios Regla Del OctetoJuanPabloMarin100% (1)
- Mecanismos de Reaccion OrganicaDocument216 pagesMecanismos de Reaccion OrganicaDenesis TejedaNo ratings yet
- Tipos de Enlaces en La Formacionde BiomoleculasDocument2 pagesTipos de Enlaces en La Formacionde BiomoleculasDanna Elvia Meza MedinaNo ratings yet
- Enlace QuimicoDocument6 pagesEnlace QuimicoShirly Torres MejiaNo ratings yet
- Unmsm - Sesion 5 - Practica Dirigida - Enlace Interatomico y MolecularDocument6 pagesUnmsm - Sesion 5 - Practica Dirigida - Enlace Interatomico y MolecularLUIS ANGEL MAMANI PALMANo ratings yet
- Leccion 4. Enlace Quimico (Estructura de Lewis)Document4 pagesLeccion 4. Enlace Quimico (Estructura de Lewis)DIEGO BORBOLLANo ratings yet
- Diagrama de Los Orbitales MolecularesDocument3 pagesDiagrama de Los Orbitales MolecularesJosue MarquezNo ratings yet
- Unidad 2 SubDocument12 pagesUnidad 2 SubNicolás GrinbergNo ratings yet
- Respuestas A Problemas SeleccionadosDocument3 pagesRespuestas A Problemas SeleccionadosMontseVillegasNo ratings yet
- Geometria Molecular PresentarDocument61 pagesGeometria Molecular Presentaralexisdario100% (2)
- Teoria de Orbitales MolecularesDocument13 pagesTeoria de Orbitales MolecularesDalia Soria100% (1)
- FUERZAS IntermolecularesDocument15 pagesFUERZAS Intermolecularesdannaeh gomez cortesNo ratings yet
- Regla Del Octeto y Estructura de LewisDocument5 pagesRegla Del Octeto y Estructura de Lewisdavid pertuzNo ratings yet
- QUÍMICADocument55 pagesQUÍMICAmilagros galanNo ratings yet
- Configuracion ElectronicaDocument43 pagesConfiguracion ElectronicaJuan Carlos Leon MartinezNo ratings yet
- Hibridación (Química)Document3 pagesHibridación (Química)José MoralesNo ratings yet
- ResonanciaDocument11 pagesResonanciaIthaisa RodríguezNo ratings yet
- Geometría MolecularDocument4 pagesGeometría MolecularALANNo ratings yet
- Enlace IónicoDocument13 pagesEnlace IónicoJuan MiguelNo ratings yet
- 1.-¿Qué Son Las Fuerzas Intermoleculares?Document4 pages1.-¿Qué Son Las Fuerzas Intermoleculares?yami vieraNo ratings yet
- Enlaces QuímicosDocument4 pagesEnlaces QuímicosChiluisa EdisonNo ratings yet
- Enlace QuímicoDocument180 pagesEnlace QuímicoJose Ignacio Flores GonzalesNo ratings yet
- Ejercicios EnlaceDocument2 pagesEjercicios Enlacevictor huayhua choqueticoNo ratings yet
- Actividad 2 Periodicidad QuímicaDocument1 pageActividad 2 Periodicidad QuímicaEsteban Sarrazola RendonNo ratings yet
- Exposicion de InorganicaDocument4 pagesExposicion de InorganicaRocio Diaz TrujanoNo ratings yet
- IntroducciónDocument58 pagesIntroducciónJaime RodriguezNo ratings yet
- UNA FIESTA ELEMENTAL Jueves 08Document4 pagesUNA FIESTA ELEMENTAL Jueves 08DIANACRISRONo ratings yet
- Enlace Químico y Nomenclatura Inorgánica 2019Document70 pagesEnlace Químico y Nomenclatura Inorgánica 2019alexisNo ratings yet